|
TRABAJO DE REVISIÓN
MODELOS PREDICTIVOS PARA ENFERMEDADES COMPLEJAS
PREDICTIVE MODELS FOR COMPLEX DISEASES
Mabel Brunotto1, Ana María Zarate1
Revista Facultad de Ciencias
Medicas 2012; 69(1):33-41
1Departamento de Biología Bucal. Facultad de Odontología.
Universidad Nacional de Córdoba
Correspondencia
Prof. Dra. Mgter. Mabel N Brunotto. Biología Celular
.Cátedra “A “-Departamento Biología Bucal Facultad de
Odontología- UNC
Haya de la Torres s/n-Pabellón Argentina Ciudad
Universitaria-CP5000- Córdoba-Argentina
brunottomabel@gmail.com
AGRADECIMIENTOS.
Secretaría de Ciencia y Técnica (SECYT-UNC)- Universidad
Nacional de Córdoba (Res Nº SECYT 214/10).
Introducción
Desde hace varios años, a nivel de salud pública, las
Enfermedades Crónicas No Transmisibles (ECNT) han comenzado
a ser el foco de todas las intervenciones en salud. Las ECNT
son las principales causas de muerte en el mundo,
produciendo más muertes cada año que todas las otras causas
combinadas. De acuerdo a los datos disponibles
aproximadamente el 80% de las muertes por ECNT se producen
en países de bajos y medianos ingresos. Sin embargo, las
muertes causadas por ECNT podrían evitarse si se
implementaran programas de prevención y diagnóstico
temprano. En el año 2008, 36 millones de muertes fueron
causadas por ECNT, como son las enfermedades
cardiovasculares, el cáncer, la diabetes y la enfermedad
crónica pulmonar.1
Una forma de abordar estas enfermedades es a través de
sistemas de vigilancia epidemiológica eficientes, entendidos
como el registro y generación de bases de datos, y la
inversión continuada en investigación, particularmente en
los entornos con bajos recursos.
El objetivo de este trabajo es describir las características
de las enfermedades crónicas complejas y algunos de los
métodos actuales de estudio de éstas en el área de la salud.
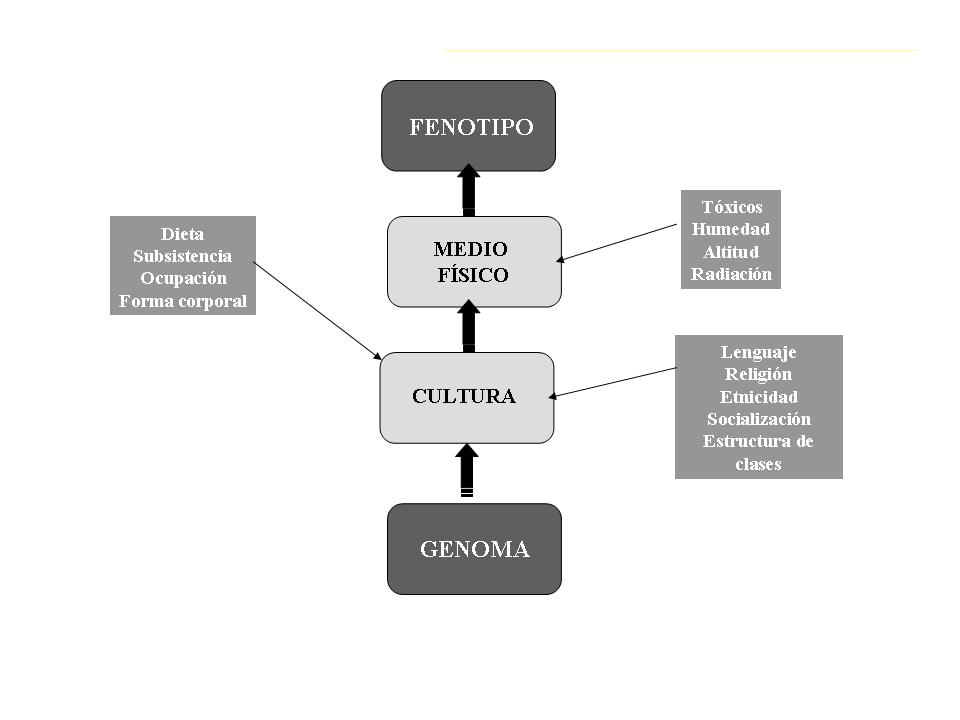
Enfermedades Complejas Crónicas
La epidemiología y genética humana han aumentado su interés
por la comprensión y condiciones en las que se producen las
enfermedades crónicas complejas como hipertensión,
enfermedad cardiovascular, asma, condiciones psiquiátricas,
cáncer, entre otras; en el desarrollo de todas ellas
participan tanto factores genéticos como medio ambientales2
(Figura 1).
 |
Estas patologías se han incrementado en cuanto a su
prevalencia y han comenzado a ser un problema de salud
pública. Los avances de la técnicas en genética han
contribuido, en muchos casos, a la comprensión de su
etiología y a un mejor diagnóstico y adecuado tratamiento de
las mismas.
Además, estudios de asociación genética han permitido
describir variantes genéticas que predisponen a desarrollar
algún tipo de enfermedad compleja. Los últimos estudios
sugieren que existe un gran número de loci, de genes
susceptibles, como base de una enfermedad compleja. Estos
resultados concuerdan con el modelo poligénico sugerido hace
un siglo por Fisher.3 Además se pueden diferenciar casos
esporádicos y de herencia familiar en las enfermedades
complejas; siendo los casos esporádicos consistentes con el
modelo de herencia poligénica.4
En estas patologías complejas, la interacción de los
distintos factores ambientales, con la expresión de varios
genes hace altamente difícil identificar el efecto aditivo o
interactivo de los genes, el medio ambiente y el contexto
sociocultural que disponen a la enfermedad; y
consecuentemente los diagnósticos no son precisos. La
identificación de variantes genéticas puede aportar
conocimiento para avanzar en nuevos descubrimientos
biológicos que permitan el desarrollo de biomarcadores
mejorando la terapéutica y prevención de grupos de riesgo.
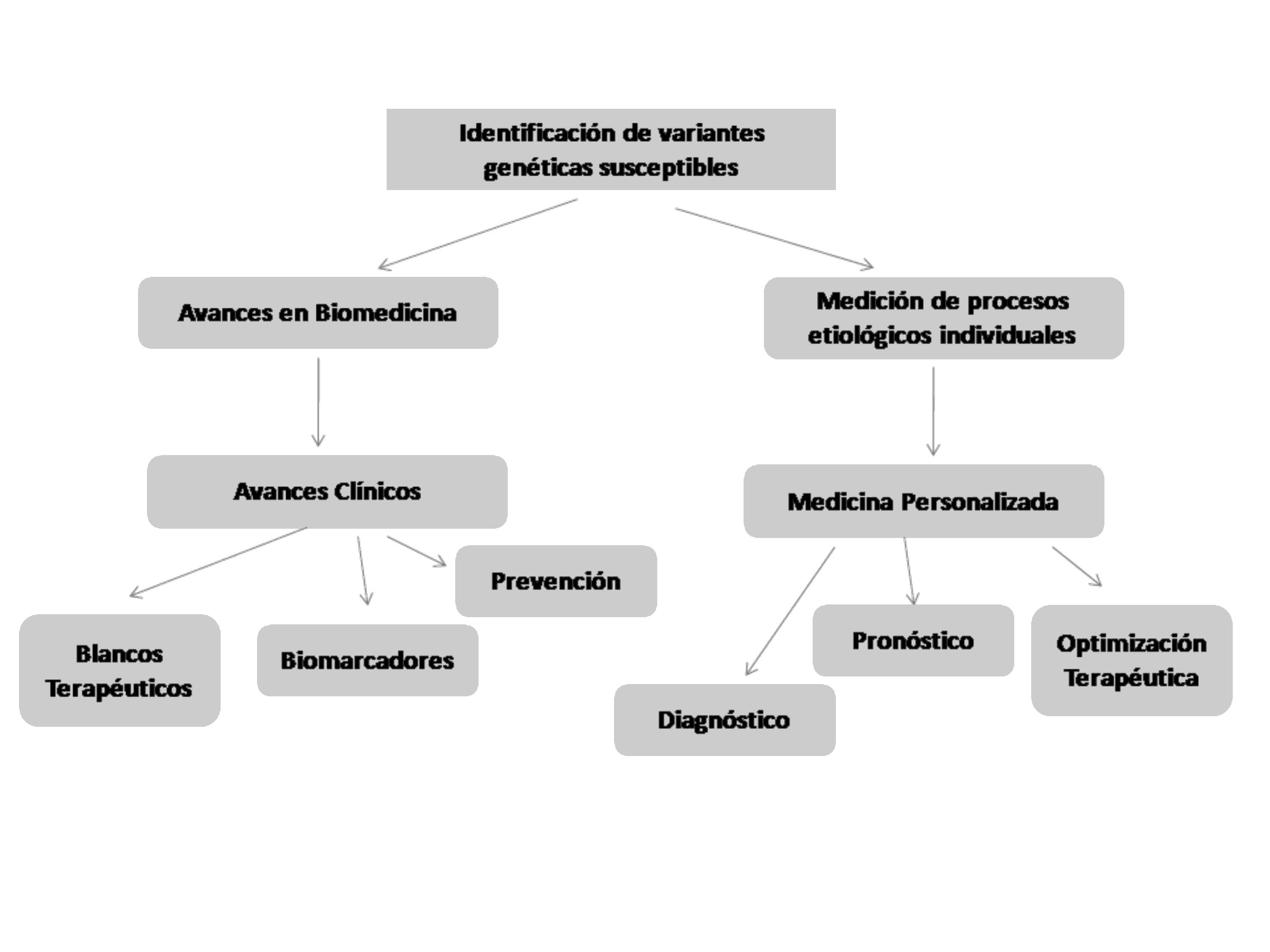
Por otra parte la medicina actual comprende que cada
individuo puede expresar un fenotipo diferencial y tiende a
una medicina personalizada que optimice tanto la terapéutica
como el diagnóstico y pronóstico de estas patologías en
individuos con riesgo de padecerlas. La utilidad de
reconocer riesgos individuales depende de la disponibilidad
de estrategias metodológicas para la predicción de la
enfermedad y de intervenciones preventivas o terapéuticas
dirigidas a los perfiles genéticos.5(Figura 2)
 |
|
Por lo cual el desafío que representan los fenotipos
multifactoriales es lograr una estrategia válida de
identificación de individuos de riesgo en la población.
Estas estrategias pueden estar orientadas al monitoreo
poblacional o a la generación de modelos predictivos
causales para detección temprana, interpretando las causas
primordiales que generan la patología.
Estrategias Metodológicas
Monitoreo
Existen tres componentes esenciales en la vigilancia de las
ECNT que constituyen los parámetros fundamentales que todos
los países deberían establecer y fortalecer. Ellos son: a)
el monitoreo de grupos expuestos a factores de riesgo; b)
monitoreo de morbilidad y de mortalidad por enfermedad; y c)
las respuestas del sistema de salud frente a estas
patologías.1
a) El monitoreo y la vigilancia de individuos en riesgo y
con bajos recursos deberían ser los componentes con mayor
prioridad en la atención primaria de salud. Un requerimiento
crítico para el monitoreo de las ECNT en todos los países es
realizar un registro confiable de la mortalidad en adultos,
reforzando el registro vital y reporte de causas específicas
de mortalidad.
b) Reforzar la vigilancia de la salud pública debe ser uno
de los ejes primordiales que deben establecerse a nivel
mundial y en cada nación. La calidad de los datos que se
recogen debe estar entre los primeros puntos a ser
considerados en las políticas de salud. Se deben fortalecer
acciones que aumenten el registro de índices epidemiológicos
mediante encuestas regulares, a escala nacional, con métodos
estandarizados, contemplando factores de riesgo; y por otra
parte evaluar periódicamente la capacidad de un país para
prevenir y controlar la prevalencia de ECNT.
c) Así como se realizar un monitoreo de los individuos en
riesgo, también debería ser monitoreada la capacidad de
respuesta del sistema de salud de un país; lo cual conlleva
a la necesidad de una aceleración significativa en la
financiación y soporte técnico para el desarrollo de un
sistema de información en salud, especialmente en países de
bajos y medianos recursos6
Sumado a las intervenciones de prevención de las ECNT sobre
toda la población, los sistemas de salud deben hacer
intervenciones individuales, esto es sobre individuos que
tengan ECNT o que estén bajo riesgo de padecerlas.
Evidencias de países desarrollados demuestran que dichas
intervenciones pueden ser muy efectivas, eficientes y de
bajo costo. Combinadas las acciones a nivel individual y de
toda la población podrían salvar millones de vidas y se
reduciría considerablemente el sufrimiento de personas que
padecen ECNT.7,8
Los pacientes con ECNT son diagnosticados, en general,
cuando presentan cuadros agudos o complicaciones a lo largo
de su vida; es por esto que en los países de medianos y
bajos ingresos se prioriza el cuidado intensivo en
instituciones de salud. Estas acciones van en desmedro de
las estrategias preventivas y resultan de un costo elevado,
desfavoreciendo el diagnóstico temprano que mejora las
estrategias terapéuticas y permiten una mejor calidad de
vida de quien padece una ECNT.
Una estrategia de acción para aumentar la detección temprana
y tratamiento a tiempo de las ECNT sería promover sistemas
de atención primaria de la salud.
Sin embargo existen serias deficiencias en la vigilancia y
monitoreo de las ECTN. Ciertos puntos claves son necesarios
de llevar a cabo para enfrentar a estas enfermedades:
1. Reforzar e integrar los sistemas de vigilancia de las
ECNT en los sistemas nacionales de información sobre salud,
existentes en cada país.
2. Estandarizar los indicadores básicos para cada uno de los
componentes esenciales de vigilancia para que puedan ser
adoptados y utilizados para el monitoreo.
3. Dar mayor prioridad a los factores de riesgo relacionados
con el comportamiento y el metabolismo en poblaciones de
bajos recurso.
4. Monitorear infecciones asociadas con ECNT.1
Modelos de causalidad
La construcción de modelos en la planificación y evaluación
de intervenciones en salud resulta una herramienta valiosa.
Los modelos, frecuentemente, son utilizados para predecir el
curso de los acontecimientos. En el contexto del campo de la
salud pública, los modelos teóricos son construidos a fin de
explicar la causalidad de los procesos biológicos,
psicológicos y sociales que intervienen en el desarrollo de
la enfermedad.
Los avances en la biología molecular y en los modelos
estadísticos aplicados a la clínica y epidemiología han
acelerado la necesidad de generar modelos antropológicos más
sofisticados para evaluar la biodiversidad en las relaciones
causa-efecto de la salud, humana.9 Sin embargo en muchos
casos sólo se evalúa el modelo desde una perspectiva
meramente estadística, y no se tienen en cuenta para la
elección del mismo los fundamentos biomédicos subyacentes
que permiten la explicación de los eventos.10-12
En el campo de las ciencias biomédicas, sociales y del
comportamiento estos avances permiten responder cuestiones
centrales pertenecientes a la naturaleza de la causa.13,14 Siendo que el proceso de salud-enfermedad no es sólo un
mero proceso biológico sino que en el desarrollo y
terapéutica del mismo resultan importantes variables
psicológicas, sociales y culturales que influyen generando
respuestas diferenciales propias de cada individuo.
La pregunta que se podría hacer es, ¿existe la factibilidad
de expresar matemáticamente la relación causal de los
síntomas y la enfermedad? El primer intento de plasmar estas
relaciones en una formulación matemática lo hizo Sewall
Wright en 1920. El utilizó una combinación de ecuaciones y
gráficas para identificar relaciones causales, dando un
primer origen a la Inferencia Causal.15La estadística
tradicional describe e infiere sobre los parámetros
distribucionales a partir de una muestra. La inferencia
causal requiere de dos ingredientes adicionales: a) un
lenguaje científico comprensible para articular el
conocimiento causal y b) una maquinaria matemática para el
procesamiento de este conocimiento; de la combinación de
ambos y con los datos obtenidos se obtienen conclusiones
causales de un fenómeno en estudio.16
Dentro de este contexto, los modelos gráficos pueden ser
considerados como un conjunto de diagramas generados a
partir de ecuaciones estructurales.17-19 Estos han sido
ampliamente utilizados en epidemiología a fin de representar
las relaciones causales entre las variables y controlar las
variables confundentes. Este modelo permite evaluar el
impacto que tienen las variables en el desarrollo de una
patología. Uno de los modelos más utilizados son los
Gráficos Directos Acíclicos (Directed Acyclic Graph- o
-DAG). Este tipo de modelo, que establece relaciones
causa-efecto, facilita la evaluación de la influencia real
de cada variable, permitiendo establecer programas
apropiados de prevención entre las poblaciones en situación
de riesgo o el examen más profundo de estudios moleculares
en patologías complejas.20
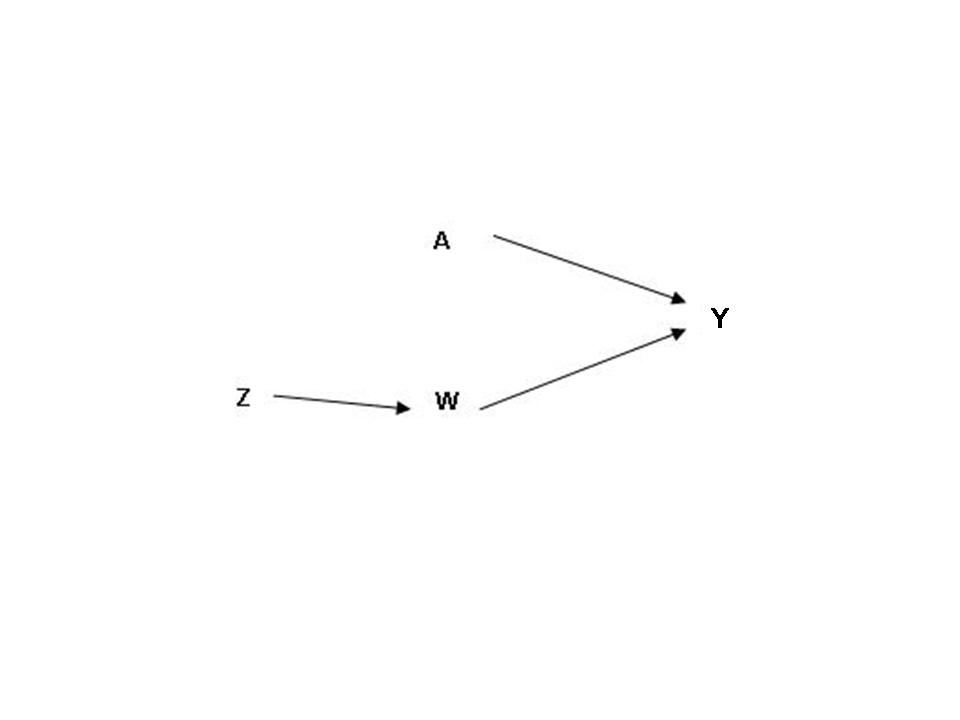
Un DAG, está compuesto por nodos (variables) y flechas
(líneas/edges). Un DAG causal es aquel en el cual las
flechas pueden ser interpretadas como su relaciones causales
y en las cuales todas las causas comunes de algún par de
variables en el gráfico también pueden ser incluidas.
En el trabajo de Pearl13 se hace la formalización de los
DAGs, en donde se considera la representación gráfica
mediante ecuaciones estructurales y cada variable es
definida como una función de su padre (variable causa),
contando un término de error aleatorio. Una relación (path)
es una secuencia de líneas desde un nodo a una variable
resultados (outcome). La gráfica es Directa Acíclica si
todos las líneas son flechas, es decir no forman un ciclo.
Cada ecuación estructural indica una respuesta simple y la
variable de influencia directa (Figura 3).
 |
|
Este nuevo enfoque es importante porque los métodos
estadísticos permiten comprender la etiología de las ECNT,
al incorporar variables causales y confundentes, con el fin
de desarrollar metodologías de diagnóstico y monitoreo
poblacional de bajo costo10 La falta de avance en esta
temática, probablemente se debe a la falta de integración de
las disciplinas, ya que en general existe una práctica
desarticulada y no se integran los conocimientos
moleculares, estadísticos y clínicos.21
Ejemplos Paradigmáticos
Cáncer
El cáncer es una de principales causas de muerte en el
mundo. La Organización Mundial de la Salud (OMS) estima que
7.6 millones de personas murieron durante el año 2005 y que
84 millones morirán en los siguientes diez años sino se
realizan acciones adecuadas. Más del 70% de los cánceres
ocurren en países de medio o bajos recursos, donde se
disponen escasos o inexistentes medios para la prevención,
diagnóstico y tratamiento del cáncer.
Se estima que el 43% de los cánceres se deben al consumo de
tabaco, a dietas no saludables, a consumo de alcohol y/o a
la asociación con procesos infecciosos. Dentro de estos
factores de riesgo, el tabaco es la causa primordial de la
mayoría de los cánceres en el mundo, tales como cáncer de
pulmón, cavidad bucal, faringe, laringe, esófago, estómago,
páncreas, hígado, riñón, vejiga, útero y médula ósea. La
exposición ambiental al humo del cigarrillo aumenta el
riesgo de cáncer. Además, si al consumo de tabaco se le
adiciona el consumo de alcohol, la persona expuesta a estos
factores incrementa su riesgo de padecer esta enfermedad.
Siendo el cáncer una patología compleja, la incidencia y los
índices de supervivencia del mismo están íntimamente
relacionados a los factores socioeconómicos. Los países con
bajos ingresos y los grupos más desfavorecidos están
generalmente más expuestos a factores de riesgo como son los
carcinógenos ambientales, alcohol, agentes infecciosos y
tabaco. Estos grupos, en general, tienen menos acceso a los
sistemas de atención y de educación para la salud. Los
cambios en el estilo de vida de estos grupos los expone a
factores de riesgo que hasta hace poco tiempo, solo eran
propios de los países desarrollados, como por ejemplo:
sedentarismo, dietas ricas en grasas animales, uso de tabaco24,25
El cáncer es en gran medida prevenible, muchos de los
diferentes tipos de cánceres pueden ser evitados por
detección temprana en su desarrollo e impedir el sufrimiento
de las personas.26
A nivel poblacional existen intervenciones que se enfocan en
la prevención del cáncer como son: la vacunación anti
hepatitis B, principal causa del cáncer de hígado;
protección contra factores de riesgo tanto ocupacionales
como ambientales tales como asbesto, aflatoxinas,
contaminantes en el agua de bebida, vacunación anti
papillomavirus humano (HPV), causa principal de cáncer bucal.1
Pero existen intervenciones basadas en cuatro grandes
enfoques para la prevención y control del cáncer:
a) Prevención primaria: prevención de ECNT en conjunto con
otros problemas de salud (como salud reproductiva,
inmunización anti hepatitis B, HIV/SIDA, salud ambiental y
ocupacional) pues ofrecen el gran potencial y el método más
rentable para el control del cáncer.
b) Detección temprana: en estadios muy tempranos cuando
existe un alto potencial de curación, contemplando las
siguientes estrategias: diagnóstico temprano, que se
relaciona con la toma de conciencia del paciente frente a
signos y síntomas, para realizar la consulta médica y
confirmar o no el diagnóstico; y monitoreo a nivel nacional
y regional de pacientes asintomáticos y aparentemente sanos,
para detectar lesiones precancerosas o estadios tempranos
del cáncer.
c) Tratamiento: que tiene como objetivo la cura de la
enfermedad, prolongar la vida y aumentar la calidad de vida
después de diagnosticado de la misma.
d) Cuidado paliativo: necesidad de todos los pacientes de
tener alivio para los síntomas y la necesidad de los mismos
y sus familiares de un soporte psico-social adecuado26
En el caso del cáncer bucal los monitoreo poblacionales
relacionadas con lesiones precancerosas bucales (LPB) y
cáncer bucal (CB), son muy costosos debidos al bajo número
de lesiones en la población en general especialmente en
países desarrollados Debido a que los programas de monitoreo
poblacional llevados a cabo por profesionales son más
confiables aunque más costosos, que la participación de los
pacientes es variable y que existen limitaciones económicas
se hace necesario dirigir los programas de monitoreo a los
individuos de alto riesgo. Un modelo de monitoreo para LPB y
CB indica que aproximadamente se necesitan que 18.000
pacientes pasen por el monitoreo para que se salve una vida.
Por lo tanto se han sugerido monitoreo de incidencia,
provistos por los médicos de atención primaria cuando los
pacientes son atendidos para otros exámenes.
Una guía adecuada para el monitoreo de cáncer oral no se ha
establecido aún. Los monitoreos oportunistas son
recomendados por la Canadian Dental Association y la
American Dental Association; estas organizaciones enfatizan
que la detección temprana permite tratamientos promisorios
en estadios tempranos de la enfermedad. Por otra parte la
Canadian Task Force on Preventive Health Care reporta que no
existe suficiente evidencia para recomendar o no el
monitoreo para el cáncer bucal. Ellos recomiendan sin
embargo exámenes anuales para pacientes de alto riesgo.27
Actualmente se vuelto a poner interés en la citología
exfoliativa (CE) como un método no agresivo, que es bien
aceptada por los pacientes por lo tanto constituye una
opción atractiva para el diagnóstico temprano del cáncer.28,29
Esta metodología es utilizada en programas
preventivos de salud pública a fin de evaluar riesgos de
cáncer genital en la población.
La cavidad bucal es fácil de examinar y algunos de los
factores de riesgo para el cáncer bucal son conocidos, este
hecho es una gran oportunidad para identificar lesiones con
potencial de malignización, mejorando el pronóstico y la
terapia de los pacientes a antes de que se desarrolle un
carcinoma bucal invasivo.30 Sin embargo aún no se ha
establecido fehacientemente como técnica de monitoreo de
cáncer bucal tal como ha ocurrido en el caso del cáncer de
útero.31
En los últimos años el éxito de la estadística en el campo
de la genética ha sido la identificación de genes que están
involucrados en la generación de una patología. A este
nivel, los modelos experimentales en animales permiten
estudiar los primeros estadios del desarrollo de la
enfermedad, permitiendo obtener resultados sobre marcadores
biológicos que puedan ser utilizado en metodologías de
diagnóstico presuntivo o monitoreo, en un futuro inmediato.
Autores como Brunotto et al.11 aplicaron, en estudios
experimentales de tumorigénesis en rata, modelos gráficos
para evaluar asociaciones entre los cambios fenotípicos
observados y tumorigénesis de órganos como glándulas
salivales mayores (submandibular). Estudiaron marcadores
genéticos como TP53 y bcl-2 en muestras de mucosa bucal de
ratas que habían sido inyectados en sus glándulas
submandibulares con 9,10-dimethyl-1,2-benzanthraceno (DMBA),
una droga ampliamente utilizada para formar tumores. Por
otra parte utilizó un modelo gráfico DAG y establecieron
relaciones causa-efecto y valoraron las asociaciones
mediante el cociente de chances (odd ratios).11 Estas
metodologías permiten valorar las alteraciones
inmunocitoquímicas y genéticas observadas en la
tumorigénesis experimental, que podrían consitutir índices
reproducibles de la transformación maligna aplicable a la
oncogénesis humana, debido al alto grado de homología entre
los oncogenes de ratones, ratas y los seres humanos.
Enfermedad Celíaca
La enfermedad celíaca (EC) es una enteropatía que afecta el
intestino delgado. Se desencadena por la activación de
células como los linfocitos B y T, produciendo una respuesta
autoinmune en personas genéticamente susceptibles cuando las
células del intestino están expuestas a prolaminas y
gluteninas del trigo, cebada, centeno y, en raras ocasiones,
avena.32,33 Esta patología, con una prevalencia de
1:100, es frecuente en países de Europa y en regiones como
el Sur de Asia, Sur de América.34
La EC es una patología compleja y a la clínica resulta
difícil clasificar a los individuos como celíacos dado que
las formas fenotípicas clínicas son diversas, manifestándose
en diferentes momentos de la vida (niñez, adolescencia y
adultez).35
En trabajos realizados por Mina et al.36 se evaluaron las
alteraciones del ecosistema bucal en niños sintomáticos con
EC, para establecer un patrón de marcadores bucales
característico que pueda ser utilizado como diagnóstico
orientativo de EC. Se estudió una muestra de n=52 de niños
con EC según criterios de ESPGAN modificados 1990. Se
realizó la evaluación clínica odontológica de los tejidos
blandos y duros. Se obtuvieron muestras de saliva, en las
cuales se midieron capacidad buffer, proteínas totales,
calcio, fosfato y se realizaron los perfiles
electroforéticos mediante SDS PAGE 12%. Además se
recolectaron citologías exfoliativas por cepillado de mucosa
bucal. Los autores observaron una baja frecuencia de
alteraciones estructurales en el esmalte, particularmente en
la dentición permanente en niños con EC. Estas alteraciones
se manifestaron con coherencia cronológica (31,7%),
bilateralidad (26,8%) y simetría (29,23%). La citología
exfoliativa en el grupo celíaco (20%) mostró la presencia
significativa de polimorfonucleares y núcleos libres. En
este mismo grupo se observaron diferencias significativas en
la capacidad amortiguadora, niveles de IgAs, volumen minuto,
calcio y relación Ca/P (p<0,05). Y a nivel de los perfiles
de proteínas se observó la desaparición de bandas de bajo,
medio y alto peso molecular en los niños celíacos. Estos
hallazgos permiten elaborar un patrón de alteraciones a
nivel del ecosistema bucal de los niños con EC. Del conjunto
de variables con mayor relevancia en los pacientes con EC
fueron las relacionadas a características de las
alteraciones del esmalte dentario morfología de la mucosa
oral y modificaciones de algunos parámetros salivales que
permitiría orientar al profesional odontólogo a derivar a
pacientes con este patrón al profesional médico competente.36
Otro estudio, realizado por los mismos autores37 valoró
el uso de algunas variables salivales en la predicción de la
EC mediante la aplicación del modelo de regresión logística.
La evaluación del desempeño de la regla de predicción
obtenida por discriminación logística fue realizada mediante
el valor del Área Bajo la Curva ROC (AUC). Las variables
salivales incluidas en el modelo correspondieron a la
concentración de proteínas totales, concentración de calcio,
relación Ca/P, capacidad buffer y flujo salival. Los
resultados obtenidos mostraron que las variables proteínas
(p=0,0016) y relación molar Ca/P (p=0,0237) estaban
asociadas significativamente a la condición celíaca. El
valor del AUC estimado a partir de las probabilidades
obtenidas por un modelo logístico mostró que los valores de
los componentes salivales permiten con un 85% de certeza
(p<0,0001) predecir la condición celíaca en un paciente. Por
lo cual concluimos que el discriminante logístico construido
con las variables salivales muestra que las mismas son
valiosas en la predicción de esta patología, ya que permiten
diagnosticarla con un 85% de certeza.37
Posteriormente estos autores20 diseñaron y evaluaron la
aplicación de modelos DAG para detectar relaciones causales
entre las variables fenotípicas en niños con EC. Estas
relaciones fueron estudiadas en un modelo longitudinal de 18
meses en niños con diagnóstico de EC y un grupo control, en
donde uno de los principales hallazgos fue la presencia de
células leucocitarias en los extendidos de mucosa bucal.
Arribaron a conclusiones que permiten presumir el
diagnóstico de la patología o evaluar el grado de adhesión a
la dieta libre de gluten por parte de los niños, generando
estrategias no invasivas y de fácil aplicación.33
Conclusión
Dado la complejidad de las patologías crónicas podemos
concluir que:
1. El trabajo interdisciplinario, de un equipo de
profesionales de la salud pertenecientes a diversas áreas
tales como la biología, odontología, bioquímica, psicología,
medicina, entre otras, permite un adecuado abordaje de las
patologías complejas.
2. La aplicación de modelos como los gráficos de causalidad
resultan una herramienta invalorable para lograr un adecuado
ajuste del modelo estadístico, permitiendo introducir todos
los componentes que intervienen en la dinámica
salud-enfermedad.
3. La mejor estrategia metodológica para las enfermedades
complejas es el diagnóstico temprano y el monitoreo de
grupos de riesgo y seguimiento de terapias de pacientes
diagnosticados.
Bibliografía
1. WHO. Global status report on noncommunicable diseases WHO
Library Cataloguing-in-Publication Data 2010. ISBN 978 92 4
068645 8
(PDF).
2. Geneau R, Stuckler D, Stachenko S, McKee M, Ebrahim S,
Basu S, Chockalingham A, Mwatsama M, Jamal R, Alwan A,
Beaglehole R. Raising the priority of preventing chronic
diseases: a political process. Lancet. 2010 13;
376(9753):1689-98.
PubMed
3. Fisher R. The correlation between relatives on the
supposition of Mendelian inheritance Trans. Roy. Soc. Edinb.
1918; 52: 399–433.
4. Yang J, Visscher PM and Wray NR. Sporadic cases are the
norm for complex disease European Journal of Human Genetics.
2010; 18, 1039–1043
Full Text
5. Janssens and van Duijn Genome Medicine 2009; 1(2).
Disponible en:
http://genomemedicine.com/content/1/2/20 .
6. Ala Alwan, David R MacLean, Leanne M Riley, Edouard
Tursan d'Espaignet, Colin Douglas Mathers, Gretchen Anna
Stevens, Douglas Bettcher et al. Monitoring and surveillance
of noncommunicable diseases: progress and capacity in
highburden countries. The Lancet Chronic Diseases Series,
2010, 376:1861–1868.
PubMed
7. Nugent R. Chronic Diseases in Developing Countries Health
and Economic Burdens Ann. N.Y. Acad. Sci. 2008; 1136: 70–79.
PubMed
8. Yach D, Hawkes C, Gould CL, Hofman KJ. The global burden
of chronic diseases: overcoming impediments to prevention
and control. JAMA. 2004 Jun 2;291(21):2616-22.
PubMed
9. Mina S, Azcurra A, Riga C, Cornejo LS, Brunotto M.
Evaluation of clinical dental variables to build classifiers
to predict celiac disease. Med Oral. 2008. Jul 1; 13 (7)
E398-402
Full Text
10. Thornton-Wells TA, Moore JH, Haines JL. Genetics,
statistics and human disease: analytical retooling for
complexity. Trends Genet 2004; 20: 640–7
Full
Text
11. Brunotto M, Zarate AM, Barra JL, Malberti A. Graph
models for phenotype and genotype association between oral
mucosa and submandibular gland tumorogenesis in rat. J Oral
Pathol Med. 2009 May;38(5):463-9
PubMed
12. Clayton D, McKeigue PM. (2001) Epidemiological methods
for studying genes and
environmental factors in complex diseases. Lancet. 358:
1356–60.
Full Text
13. Pearl J. Causal diagrams for empirical research.
Biometrika.1995; 82(4):669-88.
Full Text
14. Pearl J. Statistics and Causal Inference: A Review. Soc
Estad e Investi Operativa. Test 2003; 12(2): 281–345.
15. Pearl J. Causal Inference in the Health Sciences: A
Conceptual Introduction Health Services & Outcomes Research
Methodology 2:189–220, 2001
Full Text
16. Pearl J. Causal inference in statistics: An overview
Statistics Surveys. 2009; 96–146
Full Text
17. Wright, S. Correlation and causation. Jour. Agric. Res.
1921a. 20: 557-585.
18. Wright, S. Systems of mating. The biometric relations
between parent and offspring. Genetics. 1921b; 6: 111-123.
Full Text
19. Marchetti GM. Independencies induced from a Graphical
Markov Model after marginalization and conditioning: the R
package ggm. J Statist Software. 2006; 15:1–15. Disponible
en:
http://www.jstatsoft.org
20. Brunotto M, Mina S. Application of Directed Acyclic
Graph for analysis of efect-cause of celiac disease.
Biometría Argentina. 2010, 1 (1): 8 – 11.
http://sites.google.com/site/biometriaargentina/articulos-publicados
21. Merikangas KR, Low NCP, and Hardy J. Commentary:
understanding sources of complexity in chronic diseases –
the importance of integration of genetics and epidemiology.
Int J Epidemiol 2006; 35: 590–2
FullText
22. Pearl J. Causal Inference in the Health Sciences: A
Conceptual Introduction Health Services & Outcomes Research
Methodology 2:189–220, 2001
23. Pearl J. Causal inference in statistics: An overview
Statistics Surveys. 2009; 96–146
24. Lopez AD, Mathers CD, Ezzati M, Jamison DT, Murray CJL,
editors. Global burden of disease and risk factors.
Washington: The Word Bank/Oxford University Press; 2006.
Full Text
25. Jamison DT, Breman JG, Measham AR, Alleyne G, Claeson M,
Evans DB, et al., editors. Disease control priorities in
developing countries. 2nd ed. Washington: The World Bank/Oxford
University Press; 2006.
Full Text
26. WHO Library Cataloguing-in-Publication Data. Prevention.
(Cancer control: Knowledge into action: WHO guide for
effective programmes; modulo 2).2007
27. Epstein J. Monitoreo for and diagnosis of oral
premalignant lesions and oropharyngeal squamous cell
carcinoma. Role of primary care physicians .Can Fam
Physician 2008; 54:870-5.
28. Mehrotra R, Gupta A, Singh Mand Ibrahim R. Application
of cytology and molecular biology in diagnosing premalignant
or malignant oral lesions. Molecular Cancer 2006; 5:11
Full Text
29. Mehrotra R, Hullmann M, Smeets R, Reichert T, Driemel
O.Oral cytology revisited. J Oral Pathol Med. 2009; 38:
161–166
PubMed
30. Böcking A, Sproll C, Stöcklein N, Naujoks C, Depprich R,
Kübler N, Handschel. Role of Brush Biopsy and DNA Cytometry
for Prevention, Diagnosis, Therapy, and Followup Care of
Oral Cancer .Journal of Oncology. 2010; 1-5.
Full Text
31. Brunotto M, Zarate AM, Malberti A, Barra JL, Reyna
Calderón O. Molecular biology: biomarkers in early stages of
oral cancer. In “Research advances in oral pathology &
medicine” Book Review Global Research Network-India. 2010;
1-14
32. Barker JM, Liu E. Celiac Disease: Pathophysiology,
Clinical Manifestations and Associated Autoimmune Conditions.
Adv Pediatr 2008 ; 55: 349–365
Full Text
33. Mina S, Riga C, Azcurra IA, Brunotto M. Oral ecosystem
alterations in celiac children: A follow-up study. Arch Oral
Biol. 2011, doi:10.1016/j.archoralbio.2011.08.017. En prensa
PubMed
34. Cataldo F, Montalvo G. Celiac disease in the developing
countries: a new and challenging public health problem.World
J Gastroenterol 2007;13:2153–9
Full Text
35. Farrell RJ and Kelly CP. Diagnosis of Celiac Sprue AJG.
2001; 96(12): 3237-3246.
36. Mina SS, Azcurra AI, Dorronsoro S, Brunotto MN.
Alterations of the oral ecosystem in children with celiac
disease. Acta Odontol Latinoam. 2008; 21:121-6.
PubMed
37. Mina S, Azcurra AI, Riga C, Cornejo LS, Brunotto M.
Evaluation of clinical dental variables to build classifiers
to predict celiac disease. Med Oral Patol Oral Cir Bucal.
2008 Jul 1;13(7):E398-402.
Full text

|