|
TRABAJO ORIGINAL
EFECTOS DE
ANTICOAGULANTES SOBRE LAS SINAPSIS INMUNOLOGICAS DE ROSETAS
MACROFAGO-LINFOCITARIAS AUTOLOGAS HUMANAS.
EFFECTS OF ANTICOAGULANTS ON THE IMMUNOLOGICAL SYNAPSES
OF HUMAN AUTOLOGOUS ROSETTES BETWEEN MACROPHAGE AND
LYMPHOCYTE
Ivón T.C. Novak, Abel D. Orquera.
Revista Facultad de Ciencias
Medicas 2012; 69(1):20-24
Instituto de Biología Celular,
Facultad de Ciencias Médicas, Universidad Nacional de
Córdoba. Av. Enrique Barros. Ciudad Universitaria, Córdoba,
5000, Argentina.
inovak@cmefcm.uncor.edu
Introducción
Durante las respuestas inmunes adaptativas los
linfocitos T reconocen péptidos antigénicos presentados por
moléculas del CMH sobre las células presentadoras de
antígenos. El área de contacto entre una célula T y una
célula presentadora de antígenos es conocida como “sinapsis
inmunológica” 1 y las múltiples interacciones que ocurren
conducen a una “señalización” para la activación de la
célula T. El fenómeno de múltiples sinapsis inmunológicas de
la Roseta Macrófago-Linfocitaria (RML)2-5 se refiere a
asociaciones celulares selectivas entre macrófagos derivados
de monocitos y linfocitos autólogos humanos, a partir de
cultivos de leucocitos totales extraídos de la sangre, que
se unen selectivamente formando rosetas con un macrófago
central y linfocitos adheridos (RMLs). Se define una RML
cuando tres o más linfocitos se encuentran unidos a un
macrófago central. Este fenómeno es tiempo de cultivo y
densidad celular dependiente. Leucocitos obtenidos
recientemente de sangre periférica son incapaces de formar
RMLs mientras que las muestras cultivadas comienzan a formar
RMLs después de 15 hs de cultivo coincidiendo con la
transformación macrofágica y la ingestión del material
autólogo a partir de la muerte de neutrófilos también
presentes en el cultivo celular total. El fenómeno RML es
impedido por inhibidores del procesamiento y presentación
antigénica y por anticuerpos monoclonales anti-Complejo
Mayor de Histocompatibilidad Clase II.6,7
Esta
interacción célula-célula en RML corresponde a la
interrelación de células T CD4+3 con compromiso del TCR,
con macrófagos a través de sus moléculas Clase II del CMH,
en la presentación antigénica en múltiples sinapsis inmunes.3,4
Las sinapsis inmunes descriptas en el fenómeno de RML
fueron observadas a partir del cultivo de células extraídas
de sangre anticoagulada con heparina sódica.2 La heparina
en su presentación puede incluir concentraciones de Sodio y
Litio. Normalmente la heparina con Litio es utilizada para
estudios bioquímicos y la sódica en recuento celular. El
EDTA (ácido etilendiaminotetraacético) es un anticoagulante
utilizado principalmente en el estudio de recuento de
células y el citrato de Sodio, generalmente se utiliza en
estudios de coagulación y es de uso común en los bancos de
sangre.8
Objetivo: Como el fenómeno RML se describió originalmente
con el uso de heparina como anticoagulante en la extracción
de sangre venosa, nos propusimos como objetivo en este
trabajo evaluar el uso de anticoagulantes alternativos para
el estudio de sinapsis inmunológicas de células extraídas de
la sangre.
Materiales y Métodos
Se utilizaron muestras de sangre humana, anticoagulada con
EDTA (Vacuette K3E) (n=10); con citrato de Sodio (109 mM)
(3,2%) (n=10) y controles con heparina sódica (25 U/ml
sangre) (2500U Northia) (n=10), muestras sanas. Las muestras
de sangre periférica por punción de sangre venosa, fueron
obtenidas por donación en anonimato, con datos de serología,
del Instituto de Hematología y Hemoterapia, Universidad
Nacional de Córdoba. Las muestras de sangre son sometidas a
las siguientes pruebas en el Instituto de Hematología y
Hemoterapia de la UNC: Hudleson (Wiener), VDRL (Wiener),
Chagas HAI (Wiener), Chagas EIE (Biomerieux), HBs EIE
(Biomerieux), HBc (Biomerieux), HCV EIE (Murex), HIV Ac EIE
(Biomerieux), HIV Ag EIE (Biomerieux), HTLV EIE (Murex).
Cultivos celulares: se realizaron cultivos autólogos de
leucocitos totales en medio TC199 (SIGMA, St. Louis, MO) Las
células fueron cultivadas en suspensión, en frascos de
vidrio cónicos estériles, a 37 C. Control de viabilidad
celular mediante el test clásico de exclusión con el
colorante Azul Tripan al 0,5 %. Muestras a 72 hs y 96 hs.
Técnica de preparación de RML2,3: todas las muestras son
cosechadas con pipeta Pasteur, previa agitación del frasco
de cultivo y con el agregado de solución fisiológica
(lavado) son centrifugadas a 200 g, 10 minutos. Las células
sedimentadas son resuspendidas en gotas de solución
fisiológica, se efectúan citopreparaciones sobre
portaobjetos, depositando gotas de dichos resuspendidos y 5
minutos después, cuando sedimentaron en cámara húmeda, se
los centrifuga a pocas g en citodispersador mediante un
dispositivo ad hoc9, para producir distribución celular y
desecar la citopreparación. Fijación en alcohol, 95º.
Coloraciones: hematoxilina y eosina (H/E), Azul de
Toluidina.
Resultados
En todos los casos con uso de heparina como anticoagulante
en la extracción de sangre se observaron RMLs a partir de
los cultivos (figuras 1 y 2). En los casos con citrato de
Sodio, no se observaron leucocitos viables en las horas de
muestreo de los cultivos. En los casos con uso de EDTA como
anticoagulante en la extracción sanguínea, se observaron
leucocitos viables en los cultivos, pero no ocurrió el
fenómeno RML, no se observaron sinapsis inmunes (figuras 3 y
4).
 |
 |
 |
 |
|
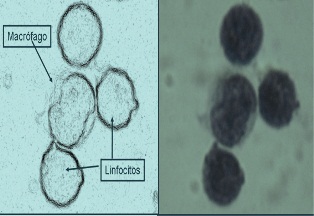
Figura 1: (RML) Roseta formada por un macrófago derivado de
monocito y tres linfocitos, 72 hs de cultivo total
leucocitario autólogo, a partir de sangre de persona sana
anticoagulada con heparina. Azul de Toluidina, 1000x.
|
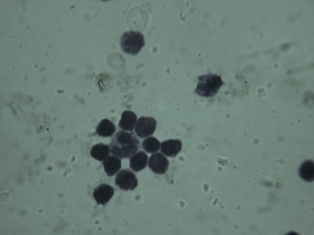
Figura 2: (RML) Roseta formada por un macrófago derivado de
monocito y numerosos linfocitos asociados, 96 hs de cultivo
total leucocitario autólogo de persona sana, a partir de
sangre anticoagulada con heparina. Azul de Toluidina, 400x. |
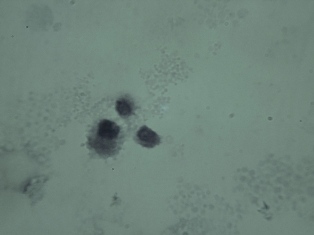
Figura 3: Muestra de 72 hs de cultivo autólogo de leucocitos
totales de sangre humana periférica sana anticoagulada con
EDTA. No se observa el fenómeno RML. 1000x (H/E).
|
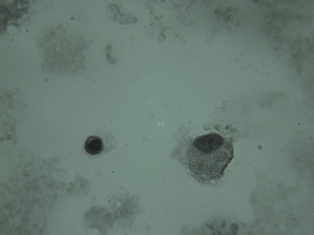
Figura 4: Un linfocito y un macrófago en muestra de 96 hs de
cultivo autólogo a partir de leucocitos totales de sangre
humana sana periférica anticoagulada con EDTA. No se observa
el fenómeno RML. 400x (H/E). |
Discusión
La interacción selectiva de múltiples sinapsis inmunes en
RMLs es tiempo de cultivo y densidad celular dependiente. Se
ha focalizado mucha atención en la organización de las
proteínas en el área de contacto entre una célula T y una
CPA, en su sinapsis inmune. En experimentos in vitro se ha
descripto a las proteínas en dos regiones, una central
denominada c-SMAC (central supramolecular activation
complex): conteniendo el receptor de célula T (TCR) y
moléculas de señalización asociadas y una periférica
denominada p-SMAC (peripheral supramolecular activation
complex), conteniendo LFA-1 y talina.10 Un contacto
inicial puede establecerse entre moléculas de adhesión del
linfocito T y la CPA, pero es el compromiso del receptor de
la célula T (TCR) con el antígeno presentado por el CMH el
que establece la estabilización de la unión en la
interacción célula-célula.11 Durante el contacto
célula-célula, el TCR y otros co-receptores causan la
polarización de la célula T, remodelando el citoesqueleto de
actina y reposicionando el aparato de Golgi y el centro
organizador de microtúbulos entre el núcleo y el área de
contacto.12,13 En cortos tiempos, las señales Ca(2+)
ayudan a estabilizar los contactos entre la célula T y la
CPA, a través de cambios en la motilidad y la organización
del citoesqueleto.14 En este trabajo los grupos en los
que se utilizaron los anticoagulantes EDTA y citrato de
Sodio en la extracción sanguínea no permitieron la
ocurrencia en los cultivos del fenómeno RML de múltiples
sinapsis inmunes ni tampoco se observaron asociaciones
individuales. Estos resultados podrían deberse tanto a las
acciones quelantes de Ca2+ del EDTA y del citrato de Sodio,
como a la inhibición de la acumulación de F-actina por EDTA14
, que afectarían las sinapsis inmunes en el fenómeno
RML. Por otra parte, en las muestras del grupo en que se usó
heparina como anticoagulante, se observaron sinapsis
inmunológicas en RMLs en los cultivos celulares autólogos,
en coincidencia con trabajos previos, en los que se utilizó
ese anticoagulante para la extracción de sangre venosa.2,7
Conclusiones
A partir de los resultados de este trabajo, acerca de los
efectos de los diferentes anticoagulantes sobre las sinapsis
inmunológicas de rosetas macrófago-linfocitarias autólogas
humanas, se puede inferir que la heparina es el
anticoagulante de preferencia en la obtención de muestras
sanguíneas para el estudio de sinapsis inmunológicas.
Bibliografía
1. Grakoui, Bromley SK, Sumen C, Davis MM, Shaw AS, Allen
PM, Dustin MI: The immunogical synapse: a molecular machine
controlling T cell activation. Science; 1999, 285: 221-227.
PubMed
2. Cabral HRA, Novak ITC: Spontaneous formation of rosettes
by autologous human monocyte-macrophages and lymphocytes in
cell cultures. Rev Fac Cienc Med Córdoba; 1992, 50: 25-26.
3. Cabral HRA, Novak ITC: Autologous rosette formation by
human blood monocyte-derived macrophages and lymphocytes. Am
J Hematol; 1999, 60: 285-288.
PubMed
4. Novak ITC, Cabral HRA: Rosettes formation by macrophages
with adhered T lymphocytes is precluded by inhibitors of
antigen processing-presentation Biocell, 2008, 32(2):
169-174.
PubMed
5. Novak ITC, Cabral HRA: Immunological Synapses Formation:
Rosettes between Human Autologous Cultured
Monocyte-Macrophages and Lymphocytes Proceedings of ECI,
2009, Medimond International Proceedings; 2009, L913C0012,
p.117-121.
6. Novak ITC, Cabral HRA: Brefeldin A and chloroquine
inhibited the formation of immunologic synapses and
autologous rosettes between cultured monocytes-macrophages
and lymphocytes. Mol Biol Cell; 2004, 15:S (suppl), abstract
p 94a 352.
7. Novak ITC, Cabral HRA: Formation of Rosettes between
Autologous Cultured Monocyte-Macrophages and Lymphocytes:
Analysis by a Regression Model. Mol Biol Cell; 2005, 16:S
(suppl), abstract p108a-109a.
8. Prieto Mencheros S, Amich Oliveras S, Sacue Martinez ML:
Laboratorio clínico. Principios Generales. Editorial
Interamericana. Mcgraw-Hill. 1993, p 245-260.
9. Cabral HRA: Los linfocitos en la Enfermedad de Chagas.
Estudio sobre algunos aspectos de la función linfocitaria.
Editado por Universidad Nacional de Córdoba, Rep. Argentina.
1984, p 201.
10. Lin JL, Miller MJ, Shaw AS: The cSMAC: sorting it all
out (or in). J Cell Biol; 2005, 170: 177-182.
Abstract
11. Underhill DM, Bassetti M, Rudensky A, Aderem AJ: Dinamic
interactions of macrophages with T cells during antigen
presentation. J Exp Med; 1999, 190: 1909-1914.
Full Text
12. Kupfer A, Dennert G, Singer SJ: Polarization of the
Golgi apparatus and the microtubule-organizing center within
cloned natural killer cells bound to their targets. Proc
Natl Acad Sci. USA. 1983; 80: 7224-7228.
13. Kupfer A, Dennert G: Reorientation of the
microtubule-organizing center and the Golgi apparatus in
cloned cytotoxic lymphocytes triggered by binding to lysable
target cells. J. Immunol; 1984, 133: 2762-2766.
14. Lewis RS: Calcium signaling mechanisms in T lymphocytes.
Annu Rev Immunol; 2001, 19:497-521.
PubMed
Agradecimiento:
Al Instituto de Hematología y Hemoterapia, Universidad
Nacional de Córdoba por las muestras donadas.

|