ARTICULO ORIGINAL
El déficit de vitamina d se asocia a
factores de riesgo en personas sin antecedentes
cardiovasculares
Vitamin d
deficiency is associated with cardiovascular risk factors in
a healthy population
Ignacio M. Seropian1, María L. Pérez Soriano2, Hernán
Kriemer2, Marcia Valdizan2, Mariana Seijo, Hernán Cohen
Arazi2
Revista Facultad de Ciencias Medicas 2013; 70(4):207-216
1.- Residencia de
Cardiología, Departamento de Cardiología, F.L.E.N.I, Buenos
Aires
2.- Centro Médico Pilares,
Pilar, Provincia de Buenos Aires
Dirección Postal
Hernán Cohen Arazi, Centro Médico Pilares, Edificio Bureau
Pilar Sur, Los Manzanos 1000 Planta baja IV local 3, 1629,
Pilar, Provincia de Buenos Aires, Argentina
e-mail:
h_c_arazi@yahoo.com
Introducción
La enfermedad cardiovascular representa la principal
causa de muerte en nuestro país y en el mundo occidental1,2.
A pesar de los avances sobre el control de los factores de
riesgo cardiovascular (FRCV) y la detección de la enfermedad
aterosclerótica, la incidencia de enfermedades
cardiovasculares aumenta a medida que la población envejece.
La vitamina D (VitD) participa del metabolismo fosfo-cálcico
y su déficit grave predispone al raquitismo en la niñez y la
osteomalacia en la adultez3. Además de sus efectos sobre el
hueso y la absorción de calcio, en los últimos años se ha
observado que la Vit D participa en la inflamación, la
replicación celular y el metabolismo en diversos tipos
celulares4-6. Estudios observacionales encontraron una
asociación entre el déficit de Vit D, los FRCV y el riesgo
de desarrollar enfermedad cardiovascular, aunque los
resultados no son concluyentes7-15. Valores disminuidos de
Vit D se asociaron a hipertensión arterial16, diabetes17,18,
síndrome metabólico19,20, depresión21 y perfil lipídico
alterado22,23.
Los valores de VitD dependen de la exposición solar y su
consumo mediante la dieta3, lo cual difiere a su vez entre
los países y las latitudes. En nuestro medio no existen
estudios que hayan evaluado la relación entre los valores de
VitD y los factores FRCV. Por ello, el objetivo de este
estudio fue evaluar la relación entre los valores de VitD y
los FRCV en una población sana, sin antecedentes de
enfermedad cardiovascular.
Materiales y Métodos
Se realizó un estudio prospectivo no probabilístico. Se
registraron todos los pacientes que concurrieron en forma
voluntaria a la “Unidad de Prevención Cardiovascular” en un
centro médico único en la localidad de Pilar (latitud
-34.48º), Provincia de Buenos Aires, Argentina, entre el 20
de Junio y el 20 de Noviembre de 2012. Los pacientes fueron
informados de su participación de carácter voluntario y de
la confidencialidad de los datos. Todos presentaban
cobertura médica (prepaga u obra social). Se realizó
anamnesis sobre FRCV (hipertensión arterial, dislipemia,
diabetes y tabaquismo), medicación habitual, antecedentes de
enfermedad vascular y la realización de actividad física
programada; se realizó examen físico con medidas
antropométricas y control de signos vitales, análisis de
laboratorio, prueba ergométrica graduada, ecocardiograma
doppler y eco doppler arterial de troncos supra-aórticos. En
este estudio preliminar no se reportan los resultados de la
prueba ergométrica ni los ultrasonidos. Se excluyeron
aquellos pacientes con antecedentes de enfermedad
cardiovascular (infarto agudo de miocardio, angina
inestable, revascularización coronaria previa, enfermedad
vascular periférica, accidente cerebrovascular) y aquellos
en los que no se pudo obtener el dosaje de VitD.
Luego de 12 h de ayuno, los pacientes fueron pesados y
medidos en una balanza mecánica con altímetro (C.A.M,
Manrique Hnos SRL, Argentina), en ropa interior y sin
calzado. Se constató la tensión presión arterial sistólica
(PAS) y diastólica (PAD) en posición sentado, luego de 5
minutos de reposo, con un tensiómetros aneroide
correctamente calibrado (San up S.A, Argentina),
realizándose el promedio de 3 mediciones. Se calculó el
índice de masa corporal (IMC) mediante la siguiente fórmula:
[peso2(kg)/altura(m)]. Se consideró sobrepeso: 25-29,9 y
obesidad ≥30 kg/m2.
El mismo día que se realizó el resto de los estudios (luego
de 12 h de ayuno), se realizó una extracción de sangre
periférica para análisis de laboratorio. Se midieron los
valores de colesterol total (CT), colesterol HDL (HDL),
colesterol LDL (LDL) y triglicéridos (TG). Los niveles de
VitD fueron evaluados mediante la concentración plasmática
de 25-hidroxi-Vitamina D (25OH-VitD) por quimioluminiscencia
(Roche®). Se consideraron valores <20 mg/dl (50 mnol/l) como
deficiencia de VitD, según las guías clínicas de The
Endocrine Society24 y recomendaciones del Institue of
Medicine (IOM)25.
Las variables continuas con distribución normal fueron
expresadas mediante media±DS. Las variables con distribución
no normal fueron expresadas como mediana y rango
intercuartilo. Las variables cualitativas fueron expresadas
como frecuencias. Para comparar variables cualitativas se
realizó el test de Chi2, mientras que se utilizó el test de
t o Wilcoxon para variables continuas. Se realizó
comparación entre cuartilos con el testo de ANOVA para
múltiples grupos. Se realizó correlación lineal mediante el
test de Pearson y regresión logística simple y multivariable.
Se consideraron diferencias estadísticamente significativas
si p<0.05.
La posibilidad de influencia de la medicación en los
resultados fue evaluada analizando si hubo diferencias
estadísticamente significativa entre aquellos pacientes con
y sin medicación mediante tabla de 2x2 y por regresión y
evaluando interacción mediante Wald test y LR test. Se
utilizó el software STATA 9.0 (STATA Corporation®, College
Station, TX).
Resultados
De 427 pacientes consecutivos que concurrieron de Julio
a Noviembre de 2012, se incluyeron 333 (78%) y fueron
excluidos 94 (22%) por no presentar valores de VitD (no
solicitados por el médico a cargo o no informados por el
laboratorio). La edad media fue de 41.6±12.4 años, el 58.6%
eran hombres. En la Tabla 1 se observan las características
de la población y una comparación de acuerdo al sexo. El
11.4% tenía antecedentes de hipertensión arterial, el 20.4%
de dislipemia, el 3% era diabético, 18.6% tabaquista, 19.8%
extabaquista, 15.9% tenía antecedentes heredofamiliares de
enfermedad cardiovascular (antes de los 60 años de edad en
un familiar directo). No se observaron diferencias
significativas en los antecedentes de acuerdo al sexo. El
50.8% realizaba actividad física programada (promedio 2.9
veces por semana).
El 2.1% se encontraba medicado con betabloqueantes, el 0.9%
con bloqueantes cálcicos, el 6.6% con inhibidores de la
enzima convertidora de angiotensina (IECA) o antagonistas
del receptor de angiotensina II (ARAII), el 1.8% con
diuréticos y el 8.4% con estatinas, sin diferencias entre
sexos.
El IMC≥25 (sobrepeso u obesidad) se observó en el 56.8%, con
mayor prevalencia en hombres (70.3% vs. 37.7%, p<0.001). El
12.5% presentó TAS≥140 mmHg y el 6% TAD≥90 mmHg en la
evaluación, sin diferencias entre sexos. Al evaluarse el
perfil lipídico, el 55.3% presentó CT>200 mg/dl, el 41% HDL<50
mg/dl y el 21.6% TG>150 mg/dl, sin diferencias entre sexos.
Al evaluarse los valores de glucemia, se observó que un
22.8% presentó valores de glucemia en ayunas ≥100 mg/dl y un
3.9% valores de HbA1c ≥6%, la glucemia promedio fue mayor en
hombres que en mujeres (97.3+13 vs. 90.9+10 mg/dl,
respectivamente, p<0.001)
|
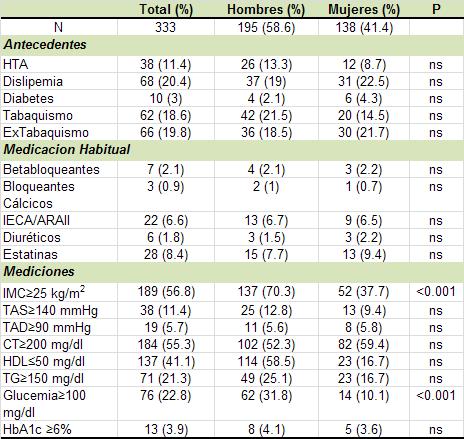 |
TABLA 1.
Características basales de la
población estudiada
|
HTA: Hipertensión arterial; IECA/ARAII: inhibidores de la
enzima convertidora de angiontesina/antangonistas delos
receptor de angiotensina II; IMC: Índice de masa corporal;
TAS: Tensión arterial sistólica: TAD: Tensión arterial
diastólica; CT: Colesterol total, HDL: colesterol de alta
densidad; TG: Triglicéridos; HBA1c: Hemoglobina glicosilada.
El valor promedio de VitD fue de 26.5±9.7 mg/dl, más alto en
mujeres (25.4±9 vs. 27.9±10 para hombres y mujeres
respectivamente, p=0.02). El déficit de VitD se observó en
el 29.1% de la población, sin diferencias entre los sexos
(31.3% vs. 26.1% para hombres y mujeres respectivamente,
p=0.3). El análisis por cuartilos de VitD fue: Q1<18.8 mg/dl,
Q2 18.8-25.7 mg/dl, Q3 25.8-32-3 mg/dl, Q4>32.3 mg/dl.
El déficit de VitD fue más frecuente en pacientes obesos (OR
1.85, IC95 1.05-3.25, p=0.02), en pacientes con HDL<50 mg/dl
(OR 1.71, IC95 1.06-2.76, p=0.02) y en aquellos con TG>150
mg/dl (OR 1.77, IC95 1.02-3.06, p=0.03). Por regresión
logística múltiple, el colesterol HDL<50 mg/dl se asoció con
déficit de VitD (OR 2.77, IC95 1.2-6.4, p=0.017)
independientemente de la edad (OR 0.99, IC95 0.97-1.03,
p=0.97), el sexo femenino (OR 1.03, IC95 0.43-2.47, p=0.93),
la obesidad (OR 1.08, IC95 0.66-1.77, p=0.75) y la actividad
física (OR 0.96, IC95 0.73-1.26, p=0.78). La asociación del
déficit de VitD con TG>150 mg/dl (OR 1.78, IC95 1.02-3.1,
p=0.04) fue independiente de la edad (OR 0.99, IC95 0.97-1,
p=0.23), la obesidad (OR 1.12, IC95 0.69-1.84, p=0.64) y el
sexo femenino (OR 1.2, IC95 0.73-1.97, p=0.45). En
concordancia con los resultados, se observó además una
correlación lineal entre los valores de VitD y los valores
de HDL (r2=0.5, p<0.001) y TG (r2=0.45, p<0.001) (Fig. 1 y 2
respectivamente). El análisis según cuartilos de VitD
también evidenció diferencias significativas respecto de la
prevalencia de HDL<50 mg/dl (Q1 58.5%, Q2 52.8%, Q3 40.5%,
Q4 26.5%, p<0.001) y de TG>150 mg/dl (Q1 28%, Q2 29%, Q3
16.7%, Q4 12%, p<0.001).
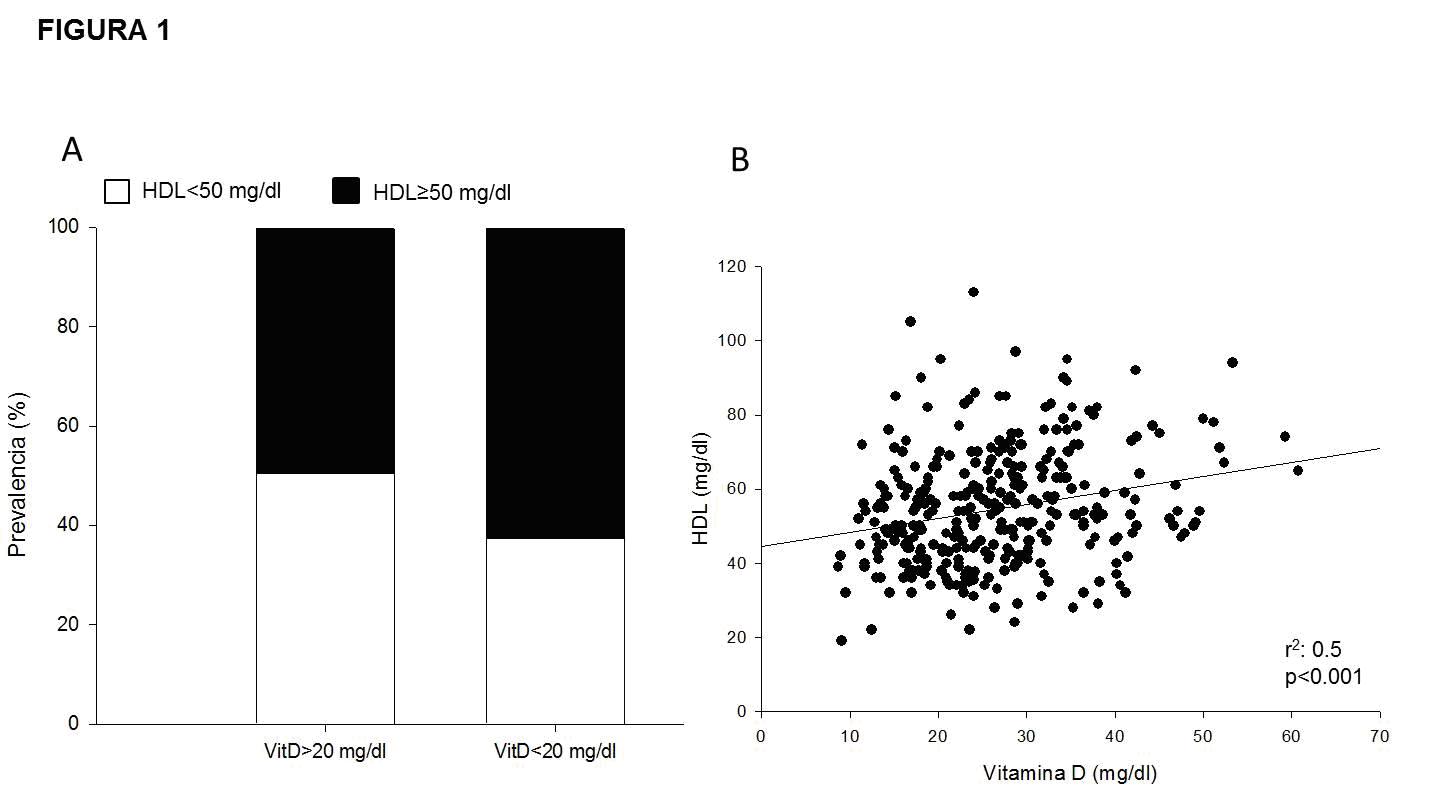 |
Figura 1. Relación entre colesterol HDL y Vitamina D. Panel
A: Prevalencia de HDL bajo (<50 mg/dl, barras negras) en
pacientes con déficit de Vitamina D (VitD, <20 mg/dl), OR
1.71, IC95 1.06-2.76, p=0.02. Panel B: Correlación lineal
entre colesterol HDL (mg/dl) y VitD (mg/dl).
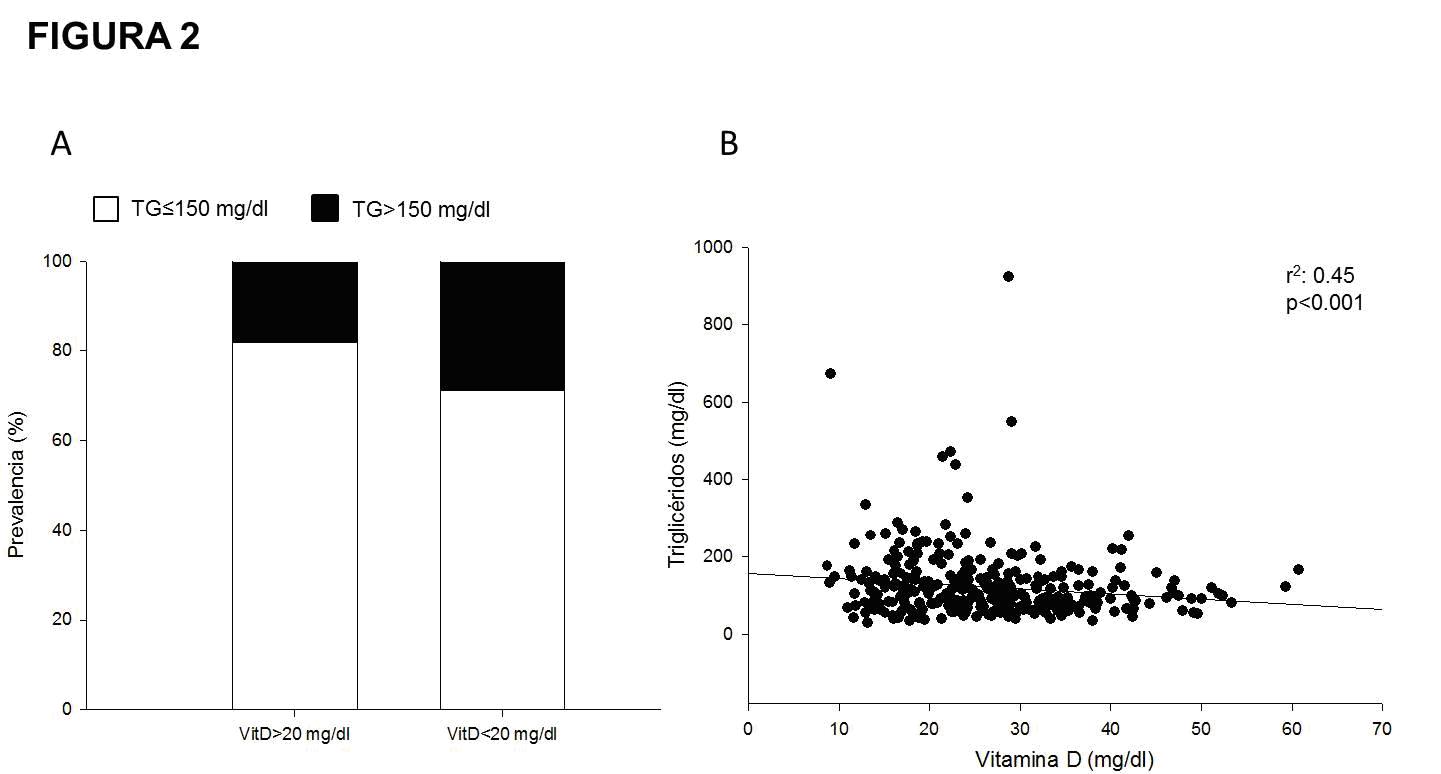 |
Figura 2. Relación entre triglicéridos (TG) y Vitamina D.
Panel A: Prevalencia de TG≥150 mg/dl (barras negras) en
pacientes con déficit de Vitamina D (VitD, <20 mg/dl), OR
1.77, IC95 1.02-3.06, p=0.03. Panel B: Correlación lineal
entre TG (mg/dl) y VitD (mg/dl).
Se evaluó la probable influencia de cualquier tipo de
medicación, ya que el 16% de los pacientes recibía algún
tratamiento. No hubo diferencias entre los paciente tratados
y no tratados respecto al déficit de VitD (p=0.28), ni hubo
influencia en el modelo de regresión en la asociación de
déficit de VitD con hipertrigliceridemia (p de
interacción=0.45), ni de HDL baja (p de interacción=0.11).
El 7% de los pacientes se encontraba bajo tratamiento con
medicación antihipertensiva, sin embargo, el tratamiento
antihipertensivo tampoco influyó en la asociación entre el
déficit de VitD y la TA (p de interacción=0.08).
Se observó también una correlación lineal entre los valores
de VitD y la PAS (r2=0.33, p=0.035) (Fig. 3), encontrándose
una tendencia estadísticamente no significativa a mayor
déficit de VitD en pacientes con TAS≥140 mmHg (OR 1.88, IC95
0.93-3.77, p=0.07) y TAD≥90 (OR 1.39 IC95 0.5-3.65, p=0.5).
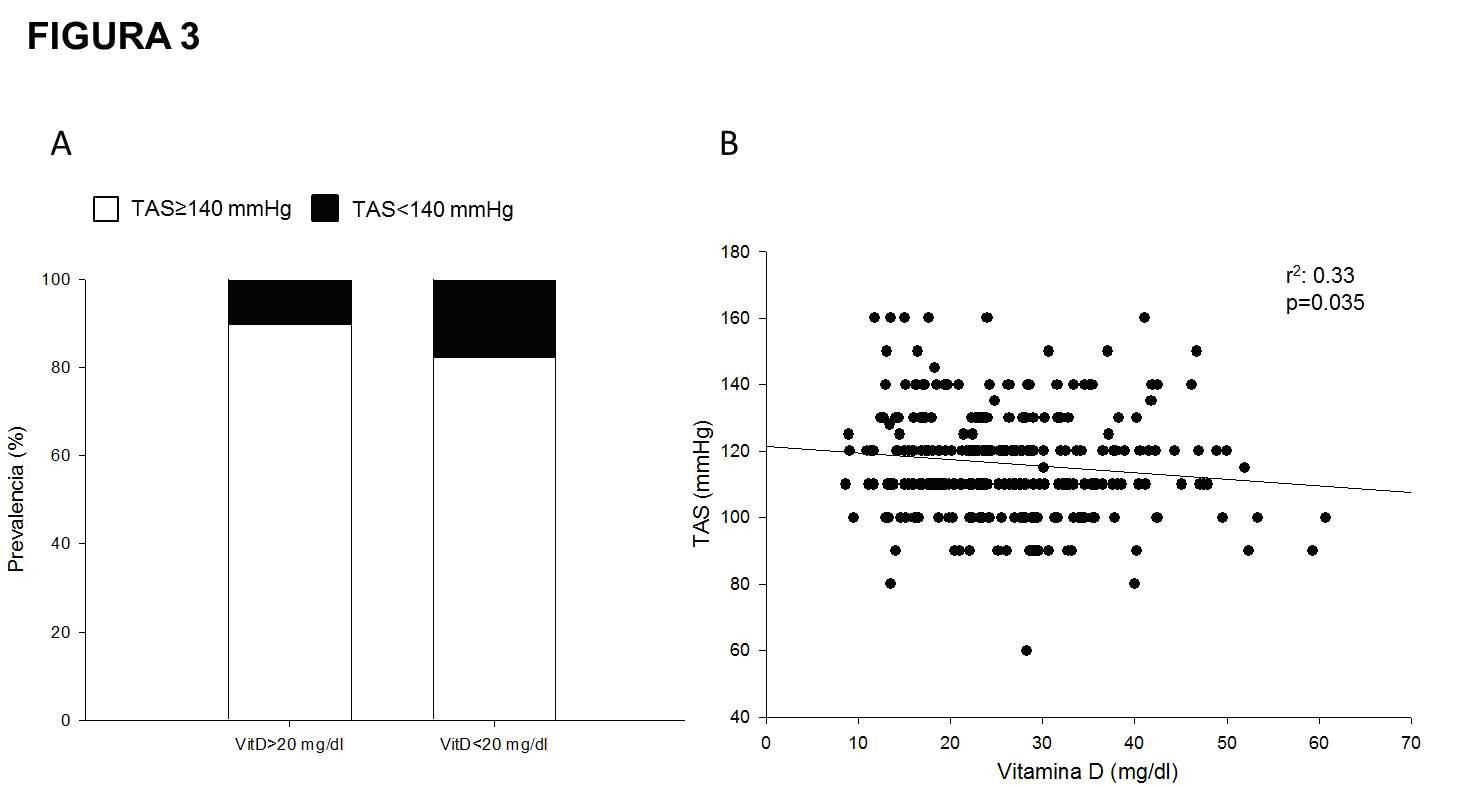 |
Figura 3. Relación entre tensión arterial sistólica (TAS) y
Vitamina D. Panel A: Prevalencia de TAS≥150 mmHg (barras
negras) en pacientes con déficit de Vitamina D (VitD, <20 mg/dl),
OR 1.88, IC95 0.93-3.77, p=0.07. Panel B: Correlación lineal
entre TAS (mmHg) y VitD (mg/dl).
No se observó mayor prevalencia de glucemia alterada en
ayunas (Glu≥100 mg/dl) ni de diabetes (HbA1c≥6%) en
pacientes con déficit de VitD (p=ns para ambas variables).
Discusión
Los efectos de la VitD sobre el metabolismo fosfo-cálcico
son ampliamente conocidos. No obstante, más recientemente,
se ha observado que la VitD puede funcionar como una
hormona3,8 y sus receptores se encuentran expresados en muy
diversos tipos celulares controlando la inflamación, la
replicación celular y el metabolismo4-6.
El metabolito activo de la VitD es la 1,25OH-VitD. Sin
embargo, los valores de 25OH-VitD se consideran el mejor
indicador del estado de vitamina D genera13,24,25. En
nuestro estudio, observamos un promedio de 25OH-VitD de 26,5
mg/dl, más alto en mujeres. Estos valores son superiores a
los observados en otros estudios que incluyeron población de
la Ciudad de Buenos Aires26-32 y podrían explicarse por las
diferentes poblaciones estudiadas (ancianos
institucionalizados, mujeres post-menopáusicas o mujeres
post-parto inmediato) y a que nuestra población habita en la
localidad de Pilar en la provincia de Buenos Aires, donde se
cuentan con mayores espacios al aire libre y viviendas
horizontales. Además, nuestra población estaría compuesta
por personas de clase media, ya que los pacientes
concurrieron a un centro privado con cobertura médica. En
nuestro estudio observamos que el 29% de las personas
presentó déficit de VitD (<20 mg/dl) La prevalencia del
déficit de VitD varía entre los países33,34, en relación a
múltiples factores incluyendo la latitud por su relación con
la radiación ultravioleta B (UVB), hábitos culturales que
limitan la exposición solar como ocurre en Oriente Medio, el
tipo de alimentación y las regulaciones gubernamentales
sobre la fortificación de algunos productos con VitD. No
obstante, a pesar que la principal fuente de VitD es la
exposición solar3, el déficit de VitD se observa incluso en
poblaciones expuestas a alta radiación UVB35, otorgándole a
la suplementación un rol protagónico en la corrección del
déficit.
Uno de los principales resultados obtenidos en nuestro
estudio fue que el déficit de VitD se asoció fuertemente al
colesterol HDL bajo (<50 mg/dl), lo cual fue confirmado
mediante el análisis por cuartilos También hubo una relación
lineal entre los valores de VitD y los del HDL independiente
de la edad, el sexo femenino, la obesidad y la actividad
física. El colesterol HDL es un conocido FRCV36, cada 1 mg/dl
de incremento de HDL se asocia con un 2%–4% de reducción de
riesgo de enfermedad cardiovascular37. A su vez, un estudio
de 257 personas observó que cada incremento de 10 mg/dl de
VitD se asoció a un aumento de HDL de 4.2 mg/dl22, mientras
que estudios de grandes magnitudes como el análisis de datos
de laboratorio de Estados Unidos23 (n=4.06 millones), el
registro National Health and Nutrition Examination Survey19
(NHANES, 2003-2006) en el mismo país (n=3529) y la cohorte
del Reino Unido20 (n=6810), encontraron una asociación
inversa e independiente entre valores altos de VitD y la
prevalencia de HDL bajo. A pesar de esta asociación, los
resultados del tratamiento con VitD sobre el colesterol HDL
son controvertidos38-40. Los efectos de la VitD sobre el
colesterol HDL podrían explicarse a través de los
moduladores del receptor de VitD EB1089 y ZK191784, que
regulan la expresión de la apolipoproteína A1, proteína
intrínsecamente relacionada con el colesterol HDL41.
En nuestro estudio también encontramos una asociación
estadísticamente significativa entre el déficit de VitD y la
hipertrigliceridemia (TG>150 mg/dl), lo cual fue confirmado
por el análisis de cuartilos y la relación lineal inversa
entre ambos parámetros. La asociación entre déficit de VitD
e hipertrigliceridemia fue independiente de la edad, la
obesidad y el sexo femenino. A diferencia del HDL, la
hipertrigliceridemia no representa un FRCV universalmente
aceptado y su rol sobre la patología cardiovascular y los
FRCV es aún incierta42. Sin embargo, otros estudios también
observaron una relación inversamente proporcional entre los
valores de VitD y los TG20,43, y la corrección del déficit
de VitD mediante dieta y exposición solar, redujo
significativamente la hipertrigliceridemia40.
El déficit de VitD se observó con mayor frecuencia en
pacientes con hipertensión arterial (PA≥140/90 mmHg) aunque
esto no alcanzó significancia estadística. No obstante, se
observó una correlación lineal inversa entre los valores de
VitD y los de PAS, confirmando la relación entre estos dos
parámetros. La VitD es un inhibidor de la renina y por ende
del sistema renina-angiotensina-aldosterona, el cual
participa activamente de la fisiopatología de la
hipertensión arterial44. En el estudio NHANES III se
encontró una diferencia de 3 mmHg de TAS entre los valores
de VitD en el 1er quintilo y el 5to quintilo45, mientras que
un meta-análisis de 3 cohortes observó que los valores más
bajos de VitD se asociaron con un riesgo del 80% de
incidencia de hipertensión arterial46. Sin embargo, el mismo
meta-análisis no encontró una reducción significativa de la
presión arterial mediante el tratamiento con VitD46
En nuestro estudio analizamos una población con baja
prevalencia de diabetes (3% con antecedentes de la
enfermedad y 3.9% con HbA1c≥6%), sin encontrar relación
estadísticamente significativa entre el déficit de VitD y la
glucemia≥100 mg/dl o la HbA1c≥6%. En este sentido, un
meta-análisis reciente observó una reducción del riesgo de
diabetes del 38% en los pacientes con valores elevados de
VitD en comparación a valores bajos, lo que se traduce en
una reducción del riesgo del 4% por cada incremento de 4 ng/ml
de VitD17. Sin embargo, los estudios de intervención con
VitD fueron inconclusos47.
Por último, observamos mayor déficit de VitD en pacientes
obesos. Esto coincide con grandes estudios como el NHANES
III19,43, y podría deberse a una disminución de la
biodisponibilidad de la VitD por su lipofilidad y por
permanecer en el tejido adiposo8.
A pesar de los importantes hallazgos de este estudio, el
trabajo presenta numerosas limitaciones que merecen ser
mencionadas. En primer lugar, se trata de un estudio con
pocos pacientes en comparación con los grandes estudios
internacionales, en un sólo centro en la Provincia de Buenos
Aires y con una población que no es representativa de la
zona ya que todos presentaban obra social o medicina
prepaga. Las mediciones de VitD fueron hechas comenzando a
principio de Junio (Invierno) pero llegando a fines de
Noviembre (Primavera), por lo que deben considerarse las
posibles variaciones estacionales como fue observado en
otros estudios en nuestro país26,30,31. Por otro lado, los
aportes de VitD provienen en su mayoría de la exposición
solar seguida de la dieta, y en este estudio no se investigó
sobre ninguno de estos dos factores. Sin embargo,
independientemente de la causa que haya llevado al déficit
de VitD, esto no condiciona los resultados encontrados y la
relación de este parámetro con los FRCV. Por último, al
tratarse de un estudio observacional, no pueden extraerse
conclusiones respecto de si existe una relación causa-efecto
entre la VitD y los FRCV o si se trata en cambio de un epi-fenómeno.
Para ello, se necesitan de estudios experimentales a fin de
responder esa pregunta.
En resumen, en este estudio en pacientes sin antecedentes
cardiovasculares de la Provincia de Buenos Aires se encontró
una asociación entre el déficit de VitD, el HDL bajo y la
hipertrigliceridemia, a la vez que una tendencia a mayor
presión arterial.
AGRADECIMIENTOS
A la Dra. Sonia Longueira y a la Dra. Alejandra Martinez
por su contribución en la recolección de la data. Al Dr.
Diego S. Enriquez por su colaboración en el diseño del
estudio.
Referencias
1. Sosa Liprandi MI, Harwicz PS, Sosa Liprandi Á. Causas de
muerte en la mujer y su tendencia en los últimos 23 años en
la Argentina. Rev Argent Cardiol 2006; 74:297-303.
Full Text
2. National Heart Lung and Blood Institute. Morbidity and
Mortality: 2012 Chart Book on Cardiovascular and Lung
Diseases. Bethesda, MD: NIH. 2012.
3. Rosen CJ. Clinical practice. Vitamin D insufficiency. N
Engl J Med. 2011;364:248-54.
PubMed
4. Nagpal S, Na S, Rathnachalam R. Noncalcemic actions of
vitamin D receptor ligands. Endocr Rev. 2005;26:662-87.
PubMed
5. Van Etten E, Mathieu C. Immunoregulation by 1,25-dihydroxyvitamin
D3: basic concepts. J Steroid Biochem Mol Biol.
2005;97:93-101.
PubMed
6. Guillot X, Semerano L, Saidenberg-Kermanac'h N, Falgarone
G, Boissier MC. Vitamin D and inflammation. Joint Bone Spine.
2010;77:552-7.
7. McGreevy C, Williams D. New insights about vitamin D and
cardiovascular disease: a narrative review. Ann Intern Med.
2011;155:820-6.
PubMed
8. Lee JH, O'Keefe JH, Bell D, Hensrud DD, Holick MF.
Vitamin D deficiency an important, common, and easily
treatable cardiovascular risk factor? J Am Coll Cardiol.
2008;52:1949-56.
PubMed
9. Lavie CJ, Lee JH, Milani RV. Vitamin D and cardiovascular
disease will it live up to its hype? J Am Coll Cardiol.
2011;58:1547-56.
PubMed
10. Tajer CD. La epidemia del déficit de vitamina D y los
estilos de la práctica clínica. Rev Argent Cardiol.
2012;80:91-7.
Full Text
11. Melamed ML, Michos ED, Post W, Astor B. 25-hydroxyvitamin
D levels and the risk of mortality in the general population.
Arch Intern Med. 2008;168:1629-37.
PubMed
12. Wang TJ, Pencina MJ, Booth SL, Jacques PF, Ingelsson E,
Lanier K, et al. Vitamin D deficiency and risk of
cardiovascular disease. Circulation. 2008;117:503-11.
PubMed
13. Giovannucci E, Liu Y, Hollis BW, Rimm EB. 25-hydroxyvitamin
D and risk of myocardial infarction in men: a prospective
study. Arch Intern Med. 2008;168:1174-80.
PubMed
14. Dobnig H, Pilz S, Scharnagl H, Renner W, Seelhorst U,
Wellnitz B, Kinkeldei J, et al. Independent association of
low serum 25-hydroxyvitamin d and 1,25-dihydroxyvitamin d
levels with all-cause and cardiovascular mortality. Arch
Intern Med. 2008;168:1340-9.
PubMed
15. Amer M, Qayyum R. Relationship between 25-Hydroxyvitamin
D and All-cause and Cardiovascular Disease Mortality. Am J
Med. 2013;126:509-14.
PubMed
16. Scragg R, Sowers M, Bell C. Serum 25-hydroxyvitamin D,
ethnicity, and blood pressure in the Third National Health
and Nutrition Examination Survey. Am J Hypertens.
2007;20:713-9.
PubMed
17. Song Y, Wang L, Pittas AG, Del Gobbo LC, Zhang C, Manson
JE, et al. Blood 25-hydroxy vitamin D levels and incident
type 2 diabetes: a meta-analysis of prospective studies.
Diabetes Care. 2013;36:1422-8.
PubMed
18. Mohr SB, Garland CF, Gorham EDm Garland FC. The
association between ultraviolet B irradiance, vitamin D
status and incidence rates of type 1 diabetes in 51 regions
worldwide. Diabetologia. 2008;51:1391-8.
PubMed
19. Maki KC, Fulgoni VL 3rd, Keast DR, Rains TM, Park KM,
Rubin MR. Vitamin D intake and status are associated with
lower prevalence of metabolic syndrome in U.S. adults:
National Health and Nutrition Examination Surveys 2003-2006.
Metab Syndr Relat Disord. 2012;10:363-72.
PubMed
20. Hyppönen E, Boucher BJ, Berry DJ, Power C. 25-hydroxyvitamin
D, IGF-1, and metabolic syndrome at 45 years of age: a
cross-sectional study in the 1958 British Birth Cohort.
Diabetes. 2008;57:298-305.
PubMed
21. Ganji V, Milone C, Cody MM, McCarty F, Wang YT. Serum
vitamin D concentrations are related to depression in young
adult US population: the Third National Health and Nutrition
Examination. Survey. Int Arch Med 2010;3:29-36.
PubMed
22. Maki KC, Rubin MR, Wong LG, McManus JF, Jensen CD,
Marshall JW, et al. Serum 25-hydroxyvitamin D is
independently associated with high-density lipoprotein
cholesterol and the metabolic syndrome in men and women. J
Clin Lipidol. 2009;3:289-96.
PubMed
23. Ponda MP, Huang X, Odeh MA, Breslow JL, Kaufman HW.
Vitamin D may not improve lipid levels: a serial clinical
laboratory data study. Circulation. 2012;126:270-7.
PubMed
24. Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM,
Hanley DA, Heaney RP, et al. Evaluation, treatment, and
prevention of vitamin D deficiency: an Endocrine Society
clinical practice guideline. J Clin Endocrinol MEtab.
2011;96:1911-30.
PubMed
25. Ross AC, Manson JE, Abrams SA, Aloia JF, Brannon PM,
Clinton SK et al. The 2011 report on dietary reference
intakes for calcium and vitamin D from the Institute of
Medicine: what clinicians need to know. J Clin Endocrinol
Metab. 2011;96:53-8.
PubMed
26. Ladizesky M, Oliveri B, Mautalen C. Niveles séricos de
25-hidroxi-vitamina D en la población normal de Buenos
Aires. Medicina (Buenos Aires) 1987;47:268-72.
LILACS
27. Oliveri M, Mautalen C, Alonso A, et al. Estado
nutricional de vitamina D en madres y neonatos de Ushuaia y
Buenos Aires. Medicina (Buenos Aires) 1993;53:315-20.
LILACS
28. Plantalech L, Knoblovits P, Cambiazzo E, et al.
Hipovitaminosis D en ancianos institucionalizados de Buenos
Aires. Medicina (Buenos Aires) 1997;57:29-35.
LILACS
29. Frandinger E, Zanchetta J. Vitamin D and bone mineral
density in ambulatory women living in Buenos Aires,
Argentina. Osteoporos Int 2001;12:24-7.
PubMed
30. Fassi J, Russo Picasso M, Furci A, Sorroche P, Jauregui
R, Plantalech L. Variaciones estacionales de 25-hidroxivitamina
D en jóvenes y ancianos de la ciudad de Buenos Aires.
Medicina (Buenos Aires) 2003;63:215-20.
LILACS
31. Costanzo PR, Elías NO, Kleiman Rubinsztein J, García
Basavilbaso NX, Piacentini R, Salerni HH. Variaciones
estacionales de 25 (OH) Vitamina D en jóvenes sanos y su
asocación con la radiación ultravioleta en Buenos Aires.
Medicina (Buenos Aires) 2011;71:336-342.
LILACS
32. Arévalo CE, Núñez M, Barcia RE, Sarandria P, Miyazato M.
Déficit de Vitamina D en mujeres adultas de la ciudad de
Buenos Aires. Medicina (Buenos Aires) 2009;69:635-9.
LILACS
33. Ginde AA, Liu MC, Camargo CA Jr. Demographic differences
and trends of vitamin D insufficiency in the US population,
1988-2004. Arch Intern Med. 2009;169:626-32
PubMed
34. Lips P, Hosking D, Lippuner K, Norquist JM, Wehren L,
Maalouf G, et al. The prevalence of vitamin D inadequacy
amongst women with osteoporosis: an international
epidemiological investigation. J Intern Med.
2006;260:245-54.
PubMed
35. Binkley N, Novotny R, Krueger D, Kawahara T, Daida YG,
Lensmeyer G. Low vitamin D status despite abundant sun
exposure. J Clin Endocrinol Metab. 2007 Jun;92:2130-5.
PubMed
36. Prospective Studies Collaboration, Lewington S, Whitlock
G, Clarke R, Sherliker P, Emberson J, Halsey J, et al. Blood
cholesterol and vascular mortality by age, sex, and blood
pressure: a meta-analysis of individual data from 61
prospective studies with 55,000 vascular deaths. Lancet.
2007;370:1829-39.
PubMed
37. Third Report of the National Cholesterol Education
Program (NCEP) Expert Panel on Detection,Evaluation, and
Treatment of High Blood Cholesterol in Adults (Adult
Treatment Panel III) final report. Circulation.
2002;106:3143-421.
38. Wang H, Xia N, Yang Y, Peng DQ. Influence of vitamin D
supplementation on plasma lipid profiles: a meta-analysis of
randomized controlled trials. Lipids Health Dis. 2012;11:42.
PubMed
39. Ponda MP, Dowd K, Finkielstein D, Holt PR, Breslow JL.
The short-term effects of vitamin D repletion on cholesterol:
a randomized, placebo-controlled trial. Arterioscler Thromb
Vasc Biol. 2012;32(10):2510-5.
PubMed
40. Al-Daghri NM, Alkharfy KM, Al-Saleh Y, Al-Attas OS,
Alokail MS, et al. Modest reversal of metabolic syndrome
manifestations with vitamin D status correction: a 12-month
prospective study. Metabolism. 2012;61(5):661-6.
PubMed
41. Wehmeier KR, Mazza A, Hachem S, Ligaray K, Mooradian AD,
Wong NC, et al. Differential regulation of apolipoprotein
A-I gene expression by vitamin D receptor modulators.
Biochim Biophys Acta. 2008;1780(2):264-73.
PubMed
42. Perk J, De Backer G, Gohlke H, Graham I, Reiner Z,
Verschuren M, et al. European Guidelines on cardiovascular
disease prevention in clinical practice (version 2012). The
Fifth Joint Task Force of the European Society of Cardiology
and Other Societies on Cardiovascular Disease Prevention in
Clinical Practice (constituted by representatives of nine
societies and by invited experts). Eur Heart J.
2012;33(13):1635-701.
PubMed
43. Martins D, Wolf M, Pan D, Zadshir A, Tareen N, Thadhani
R, et al. Prevalence of cardiovascular risk factors and the
serum levels of 25-hydroxyvitamin D in the United States:
data from the Third National Health and Nutrition
Examination Survey. Arch Intern Med. 2007;167(11):1159-65.
PubMed
44. Li YC, Kong J, Wei M, Chen ZF, Liu SQ, Cao LP. 1,25-Dihydroxyvitamin
D(3) is a negative endocrine regulator of the renin-angiotensin
system. J Clin Invest. 2002;110(2):229-38.
PubMed
45. Scragg R, Sowers M, Bell C. Serum 25-hydroxyvitamin D,
ethnicity, and blood pressure in the Third National Health
and Nutrition Examination Survey. Am J Hypertens.
2007;20(7):713-9.
PubMed
46. Pittas AG, Chung M, Trikalinos T, Mitri J, Brendel M,
Patel K, et al. Systematic review: Vitamin D and
cardiometabolic outcomes. Ann Intern Med.
2010;152(5):307-14.
PubMed
47. de Boer IH, Tinker LF, Connelly S, Curb JD, Howard BV,
Kestenbaum B, et al. Women's Health Initiative Investigators.
Calcium plus vitamin D supplementation and the risk of
incident diabetes in the Women's Health Initiative. Diabetes
Care. 2008;31(4):701-7.
Full Text
|