|
Infecciones seminales en
pacientes infértiles asintomáticos
Rosa I. Molina¹,
Andrea D. Tissera¹,
José J. Olmedo²,
Benjamín Allende Pinto, Ximena Kiguen¹,
Cecilia Cuffini¹.
Revista
Facultad de Ciencias Médicas 2009; 66(Supl.1): 60-66
1-Laboratorio de Andrología y
Reproducción (LAR). Centro Integral de Ginecología y
reproducción (CIGOR)
2-Instituto de Virología, FCM,
UNC. Córdoba, Argentina.
Introducción
La infección genital es la principal causa de esterilidad en
el mundo, no sólo en patología tubárica, sino que afecta
también cada una de las diversas partes de la anatomía
genital, tanto masculina como femenina.
Varios estudios sugieren que uno o más agentes infecciosos
en el tracto genitourinario podrían estar asociados con la
infertilidad masculina.
(1,2,3,4)
Algunos de estos microorganismos han
sido considerados flora saprófita pero la presencia de otros
como Chlamydia trachomatis (C. trachomatis), Ureaplasma
urealyticum (U. urealyticum) en el tracto genital están
fuertemente asociados a enfermedades por obstrucción
tubárica. La infección por C. trachomatis es
actualmente considerada como una importante causa de
uretritis no específica y epididimitis en el varón, y de
enfermedades pélvicas inflamatorias y cervicitis en la
mujer, produciendo en ocasiones infertilidad.
El primer Mycoplasma hominis (M. hominis) fue
encontrado en mujeres con vaginosis bacteriana con más
frecuencia que en mujeres asintomáticas. (5) M. hominis
ha sido aislado de endometrio y de trompas de Falopio de
mujeres con salpingitis. (6) Estudios realizados en mujeres
con tratamiento de fertilización “in vitro” mostraron la
presencia de M. hominis sólo en 2,1% de ellas.
(7)
La importancia de las infecciones genitales, en la
etiopatogenia de las alteraciones seminales asociadas a la
infertilidad masculina, es aun controversial. El objetivo del presente
trabajo fue determinar en muestras de semen de varones
asintomáticos, que consultaron por alteraciones en su
fertilidad; el impacto de las bacterias Gram negativas y
positivas,
C. trachomatis,
M. hominis y U. urealyticum en la calidad espermática.
Materiales y Métodos
Durante el año 2007, se analizaron 241 muestras de semen de
pacientes no azoospérmicos entre 20 y 60 años de edad que
consultaron por alteraciones de su fertilidad, con al menos
2 días de abstinencia sexual previa al análisis, sobre los
cuales se realizó examen bacteriológico para uno o más
gérmenes. La muestra incluye 128 sujetos (53,1%) sin
descendencia en los últimos 2 años (89,1% corresponden a
esterilidad primaria). No presentaban síntomas o signos compatibles con una infección de
transmisión sexual (ITS) y fueron considerados
asintomáticos. No habían recibido tratamiento antimicrobiano
específico durante los últimos 10 días. Con pareja estable
al momento de la consulta y de un nivel socio económico
medio-alto.
Al no estar estandarizado; en el ambiente médico, un
protocolo de investigación del factor infeccioso en los
pacientes que consultan por infertilidad, no se solicita la
investigación conjunta de Gémenes comunes (GC),
C. trachomatis, M. hominis y U. urealyticum
en todas las muestras de
semen.
Por esta razón se investigó la presencia
de gérmenes comunes (GC) en 208 casos (86,3%),
M. hominis y U. urealyticum
en 102 (42,3%) y
C. trachomatis
en 106 casos (44,0%),
Se cultivaron 208 muestras en Agar Sangre para evaluar el
desarrollo de
Staphylococcus aureus, Escherichia coli, Staphylococcus
epidermitis, Staphylococcus coagulasa negativa,
Streptococcus grupo B.
Se realizó el aislamiento en cultivos celulares de C.
trachomatis; en 106 muestras, revelado por Anticuerpos
monoclonales marcados con FITC (Vircell), como se describe
en la bibliografía (8) y optimizado en nuestro laboratorio.
(9)
Se detectó la presencia de M. hominis con el equipo
comercial Mycofast Evolution II y con el mismo método se
observó el desarrollo de U. urealyticum en 102
muestras. (10)
Análisis de rutina del semen
Los parámetros seminales fueron evaluados según normas OMS
1999 y morfología según criterios estrictos de Kruger 1986 y
OMS 1992. Se evaluó para cada muestra volumen, pH,
concentración, motilidad, vitalidad, leucocitos y bioquímica
seminal para evaluar el estado de las glándulas anexas:
Fructosa, ácido Cítrico y Alpha glucosidasa. Todos los
procedimientos de laboratorio se encontraron sometidos a
sistemas de Control de Calidad Interno (cartas de control
mensual, Coeficientes de variación intra e interoperador) y
Externo (Programa de Evaluación Externa- PEEC), para
optimizar la calidad de los procesos de evaluación de las
muestras. (11,12)
Análisis estadístico
A fin de homogeneizar la presentación de los datos, las
variables cuantitativas se expresaron en términos de mediana
y rango intercuartílico (RI), salvo que se especifique lo
contrario en el cuerpo de resultados. Para el contraste de
edad, abstinencia y los distintos parámetros seminales se
utilizó por defecto la prueba no paramétrica U de
Mann-Whitney.
Para el contraste de proporciones entre series o grupos
independientes se utilizó prueba de Chi cuadrado (x2)
o Test Exacto de Fisher (TEF) según la necesidad del caso.
El análisis de los efectos multivariados de leucospermia,
M. hominis y U. urealyticum
en relación a la movilidad espermática se realizó mediante
análisis de varianza inter-especímenes de efectos
principales e interacción.
Resultados y Discusión
Se estudió la presencia de GC en 208 casos (86,3%),
M. hominis y U. urealyticum
en 102 (42,3%) y C. trachomatis en 106 casos (44,0%),
siendo los resultados positivos de 15,4% (n = 32), 7,8% (n =
8), 23,5% (n = 24) y 23,6% (n = 25) respectivamente.
M. hominis y U. urealyticum
tienden a asociarse, en nuestro estudio,
5 de 8 M. hominis positivos
contra sólo 19 de 94 M. hominis negativos
eran también
U. urealyticum
positivos (62,5% versus 20,2% respectivamente; TEF
p = 0,015); o bien, 5 de 24
U. urealyticum
positivos contra 3 de 78
U. urealyticum
negativos resultaron también
M. hominis positivos
(20,8% versus 3,8% respectivamente). Esto también
implica que
M. hominis
prácticamente no se viera aislado de
U. urealyticum.
La investigación de todos los gérmenes se realizó en 70
casos, observándose 38 estudios bacteriológicos positivos
(54,3%, a uno u otro germen) y 32 negativos, no
evidenciándose diferencias estadísticamente significativas
entre ambas categorías de resultado bacteriológico en cuanto
a los parámetros seminales estudiados (ver
Tabla I). Sin embargo,
llama la atención la menor concentración de alpha-glucosidasa
por volumen eyaculado en presencia de uno o más gérmenes,
más aún si se ajusta la concentración de dicho marcador a 1
ml de volumen eyaculado (U p exacta = 0,133).
La presencia de leucospermia en la muestra fue 31,5% (n =
76), y sin tomar en consideración los resultados
bacteriológicos, se pudo apreciar una relación significativa
de leucospermia con mayor edad y menor abstinencia de los
sujetos, así como un significativo menor porcentaje de
espermatozoides móviles (ver
Tabla II).
Al considerar aisladamente los resultados bacteriológicos de
GC y C. trachomatis (Tablas
III y IV), notamos
que en ambos casos no hubo diferencias estadísticamente
significativas en los parámetros seminales entre
bacteriológicos positivos y negativos.
Por el contrario, al comparar especímenes
M. hominis
y/o
U. urealyticum
positivos respecto a ambos negativos (ver
Tabla V), notamos que la
presencia de uno o ambos gérmenes deteriora
significativamente la movilidad espermática, y no
significativamente, la concentración y morfología normal
estricta de los espermatozoides y los valores medianos de
alfa – glucosidasa seminal. La concentración de leucocitos
se encuentran aumentados en los cultivos positivos, pero las
diferencias no son estadísticamente significativas.
Tanto 10 muestras de 25 C. trachomatis positivas como
32 de 81 C. trachomatis negativas (40% vs. 39,5%;
x2 p = 0,965) mostraron leucospermia, así
como 8 de 32 GC positivos y 53 de 176 GC negativos (25% vs.
30,1%; x2 p = 0,559); por lo que no
pareció haber asociación entre GC o C. trachomatis y
leucospermia. Por el contrario, aunque no significativo, la
leucospermia estuvo presente en 14 de 27
M. hominis y/o
U. urealyticum
positivos contra 26 de 75 M. hominis
y/o
U. urealyticum
negativos (51,9% vs. 34,7%; x2 p = 0,117).
Nótese que la leucospermia está presente en 9 de 32 casos de
bacteriología negativa a todos los gérmenes (28,4%), por lo
que un 51,9% de leucospermia en
M. hominis
y/o
U. urealyticum
positivos es una prevalencia considerable. Es entonces que
M. hominis
y
U. urealyticum
guardaron relación (estadísticamente no
significativa) con la leucospermia, y ambos a la vez con
una menor movilidad espermática.
El análisis de varianzas inter-especímenes nos permitió
observar un efecto principal significativo de
M. hominis
y/o
U. urealyticum
sobre los valores medios de movilidad
espermática (Eta2 6,1%; p = 0,013),
mientras que la leucospermia y la interacción de ésta con
M. hominis
y/o
U. urealyticum
no resultaron significativas (Eta2
< 1% en ambos casos; p = 0,489 y 0,923
respectivamente). Las medias marginales de movilidad
espermática correspondientes resultaron 35,1% (error
estándar 4,1) y 47,5% (error estándar 2,6) para especímenes
M. hominis
y/o
U. urealyticum
positivos y sus pares
M. hominis
y/o
U. urealyticum
negativos, siendo el efecto asociado una disminución media
de movilidad en 12,35 puntos porcentuales (IC95% 2,7-22,0).
En conclusión, la relación entre resultados bacteriológicos
y parámetros seminales en nuestra muestra de pacientes,
pareció depender en gran medida de cual o cuáles gérmenes se
encontraban presentes en el semen. La presencia de Gérmenes
Comunes o de C. trachomatis no pareció mostrar un
impacto significativo en los parámetros seminales, por el
contrario la presencia de
M. hominis
y/o
U. urealyticum
mostraba un efecto deletéreo
significativo sobre la movilidad espermática, así como
efectos aún no bien establecidos sobre concentración y
morfología normal estricta. La “más aparente que real”
asociación entre menor movilidad espermática y leucospermia
tendría su origen entonces en la frecuente relación de esta
última condición con la infección por
M. hominis
y/o
U. urealyticum.
El mecanismo por el cual los procesos infecciosos
provocarían infertilidad masculina aún no está claro.
Se asume que la infección bacteriana del tracto genital, en
particular con C.trachomatis puede estimular una
respuesta autoinmune en el epidídimo que ocasione
obstrucción unilateral o la exposición de los
espermatozoides a las células competentes del sistema
inmunológico. (13,14,15,16)
Esta infección puede causar oclusión en el sistema
canalicular del tracto genital masculino, podría dañar las
células epiteliales involucradas en la espermatogénesis.(17)
En algunos trabajos
realizados en muestras de varones no se ha demostrado una
relación de la presencia de anticuerpos contra
C.trachomatis y la calidad seminal. (18,19,20,21)
Un
estudio realizado por Gallegos y col, reveló que el semen de
los hombres afectados por C. trachomatis y Mycoplasma
presentaba niveles de fragmentación del ADN de entre el 35
y 45 por ciento, mientras que en las personas no infectadas,
esos niveles eran de aproximadamente un 15 por ciento.
Descubrieron que estos patógenos dañan el ADN, aunque
la infección que provocan no presenta síntomas y no alteran
significativamente los parámetros seminales habituales de
concentración, morfología y motilidad de los
espermatozoides. Asimismo, los investigadores descubrieron,
tras aplicar en los varones infectados un tratamiento
antibiótico de entre tres y cuatro meses, que el daño del
ADN que originan C. trachomatis y
M. hominis
puede ser en
parte reparado, y que es posible recuperar la fertilidad.
(22)
Se ha demostrado que C. trachomatis
y M. hominis
se adhieren a
la cabeza del espermatozoide que actuaría como vehículo para
el ascenso de la bacteria por el tracto genital
femenino. (23,24)
La infección asintomática que producen en un alto porcentaje
estos agentes patógenos aumenta el riesgo de transmisión por
vía sexual; los parámetros que de rutina se miden en un
espermograma son poco sensibles e inespecíficos para
determinar la infección de algunos de estos agentes
patógenos; por lo que resulta indispensable realizar un
estudio microbiológico específico completo, incluyendo a
C. trachomatis,
M. hominis y U. urealyticum
en los pacientes que consultan por
fertilidad. También sería muy importante evaluar las
poblaciones jóvenes sexualmente activas, y en caso de ser
detectados estos agentes patógenos indicar la terapia
antimicrobiana específica para el sujeto y su pareja sexual
para prevenir las consecuencias futuras de estas
infecciones, como la infertilidad que tiene altos costos
sicológicos para quienes la padecen y económicos para los
sistemas de salud.
Tablas
Tabla
I.- Valores medianos y dispersión de edad, abstinencia y
parámetros seminales en especimenes con Bacteriología
positiva a uno o más gérmenes versus Bacteriología negativa
(N = 70).
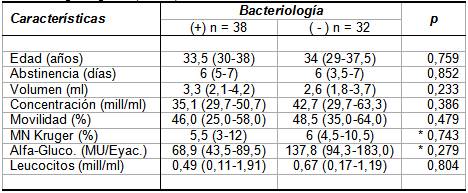
Los valores en tabla representan mediana e RI
entre paréntesis (P25-P75).
p: Significación estadística asintótica de
una prueba U bilateral de Mann-Whitney, excepto en
contrastes indicados con asterisco (*), en que se utilizó
prueba con significación exacta.
Tabla
II.- Valores medianos y dispersión de edad, abstinencia
y parámetros seminales en especimenes con versus sin
Leucospermia (N = 241).
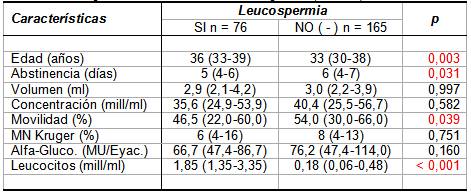
Los valores en tabla representan mediana y
rango intercuartílico entre paréntesis (P25-P75).
p: Significación estadística asintótica de
una prueba U bilateral de Mann-Whitney.
Tabla III.- Valores medianos y dispersión de edad,
abstinencia y parámetros seminales en especimenes
bacteriológicamente positivos y negativos a Gérmenes Comunes
(N = 208).
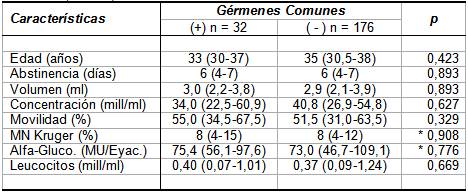
Los valores en tabla representan mediana e RI
entre paréntesis (P25-P75).
p: Significación estadística asintótica de
una prueba U bilateral de Mann-Whitney, excepto en
contrastes indicados con asterisco (*), en que se utilizó
prueba con significación exacta.
Tabla IV.- Valores medianos y dispersión de edad,
abstinencia y parámetros seminales en especimenes
bacteriológicamente positivos y negativos a C.trachomatis
(N = 106).
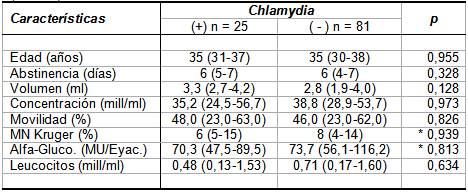
Los valores en tabla representan mediana e RI
entre paréntesis (P25-P75).
p: Significación estadística asintótica de
una prueba U bilateral de Mann-Whitney, excepto en
contrastes indicados con asterisco (*), en que se utilizó
prueba con significación exacta.
Tabla
V.- Valores medianos y dispersión de edad, abstinencia y
parámetros seminales en especimenes bacteriológicamente
positivos y negativos al conjunto M. hominis +
U.urealyticum (N = 102).
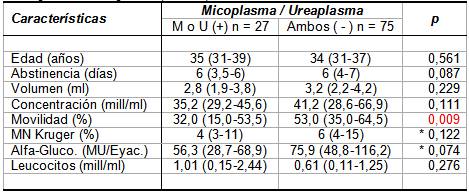
Los valores en tabla representan mediana e RI
entre paréntesis (P25-P75).
p: Significación estadística asintótica de
una prueba U bilateral de Mann-Whitney, excepto en
contrastes indicados con asterisco (*), en que se utilizó
prueba con significación exacta.
Agradecimientos
Este trabajo fue subsidiado por la Secyt.
Bibliografía
1- Rehewy MS, Hafexz MS, Thomas A, et al.
Aerobic and anaerobic bacterial flora in semen from fertile
and infertile groups of men. Arch Androl; 1979, 2 : 263 –
268.
[Abstract]
2-Swenson CE, Toth A, Toth C, et al. Asymptomatic
bacteriospermia in infertile men.
Andrologia; 1980, 12 : 7 - 11. [Abstract]
3- Makler A, Urbach Y, Lefler E, et al. Factors affecting
sperm motility. VI. sperm viability under the influence of
bacterial growth in human ejaculates. Fertil Steril; 1981,
35 : 666 - 670
[Abstract]
4- Witkins SS, Toth A. Relationship between genital tract
infections, sperm antibodies in seminal fluid and
infertility.
Fertil Steril; 1983, 40: 805-808
5- Rosenstein IJ, Morgan DJ, Sheehan M, Lamont RF,
Taylor-Robinson D: Bacterial vaginosis in pregnancy:
distribution of bacterial species in different gram-stain
categories of the vaginal flora.J Med Microbiol; 1996, 45:120-126.[Fulltext]
6- Mardh PA, Westrom L: Tubal and cervical cultures in acute
salpingitis with special reference to Mycoplasma hominis and
T-strain mycoplasmas.Br J Vener Dis; 1970, 46:179-186.
[Open Access - PubMed Central]
7- Witkin SS, Kligman I, Grifo JA, Rosenwaks Z: Ureaplasma
urealyticum and Mycoplasma hominis detected by the
polymerase chain reaction in the cervices of women
undergoing in vitro fertilization: prevalence and
consequences.
J Assist Reprod Genet; 1995.[
Open Access - PubMed Central)
8-Young, J.L., L. Smith, M. K. Matyszak, and J. S. Gaston.
HLA-B27 expression does not modulate intracellular Chlamydia
trachomatis infection of cell lines. Infect Immun;2001,
69:6670-6675.[Open
Access-PubMed Central]
9- Cuffini et al.
Isolation of Chlamydophila pneumoniae from atheromas
of the carotid artery and their antibiotics susceptibility
profile. Enferm Infecc Microbiol Clin; 2006, 24:81-5.
[Fulltext]
10- Taylor-Robinson D. Ureaplasma urealyticum and
Mycoplasma hominis p 1713-1718., Dans Mandell G.L., J.E.
Bennet and Dolin (ed) Principles and Practices of Infectious
Diseases, 4th ed.vol 2, Churchill Livingstone, New York;
1995.
11- World Health Organisation. WHO Laboratory Manual for the
examination of human semen and semen-cervical mucus
interaction. Cambridge University Press, Cambridge, UK, 1992
y 1999.
12- Kruger TF, Menkvel R, Stander FS, Lombard CJ, Van der
Merwe JP, Van Zyl JA, Smith K. Sperm morphology features as
a prognostic factor in in vitro fertilization. Fertil Steril;
1986, 46:1118-1123.[Abstract]
13- Witkin SS, Toth A. Relationship between genital tract
infections, sperm antibodies in seminal fluid and
infertility.
Fertil Steril; 1983, 40 : 805 - 808.
14- Soffer Y, Ron - El R, Golan A, et al.
Male genital mycoplasmas and Chlamydia trachomatis culture:
its relationship with accessory gland function, sperm
quality and autoimmunity. Fertil Steril; 1990, 53: 331 -
336,
[Abstract]
15- Munoz MG, Witkin SS.
Autoimmunity to spermatozoa, asymptomatic Chlamydia
trachomatis genital tract infection and ST lymphocytes in
seminal fluid from the male partners of couples with
unexplained infertility. Hum Reprod; 1995, 10: 1070 - 1074.
[Abstract]
16- Witkin SS, Kligman I, Bongiovanni AM. Relationship
between an asymptomatic male genital tract exposure to
Chlamydia trachomatis and an autoimmune response to
spermatozoa.
Hum Reprod; 1995, 10: 2952-2955.[Abstract]
17-Nilsson S, Obrant KO, Persson PS.
Changes in the tests parenchyma caused by acute non-specific
epididymitis.
Fertil Steril;1968, 19: 748 - 757.
18- Close CE, Wang SP, Roberts PL, et al.
The relationship of infection with Chlamydia trachomatis to
the parameters of male infertility and sperm autoimmunity.
Fertil Steril; 1987, 48 : 880 - 883. [Abstract]
19- Ruijs GJ, Kauer FM, Jager S, et al.
Is serology of any use when searching for correlations
between Chlamydia trachomatis infection and male
infertility? Fertil Steril; 1990, 53: 131 – 135.
[Abstract]
20- Bjercke S, Purvis K. Chlamydial serology in the
investigation of infertility.
Hum Reprod; 1992, 7 : 621 – 624.
[Abstract]
21- Eggert - Kruse W, Gerhard I, Naher H, et al.
Chlamydial infectiona female and /or male infertility
factor?
Fertil Steril; 1990, 53 1037- 1043
[Abstract]
22-
Gallegos G,
Ramos B,
Santiso R,
Goyanes V,
Gosálvez J,
Fernández JL.
Sperm DNA fragmentation in infertile men with genitourinary
infection by Chlamydia trachomatis and Mycoplasma.
Fertil Steril;2008,
90:328-34.[Abstract]
23- Gallegos-Avila G.,Ortega-Martinez M., Ramos-Gonazles B.,
Jaramillo-Rangel G. Ultrastructural findings in semen
samplesof infértil men infected with Chlamydia tracomatis
and micoplasma. Fértil& Steril;2009, 91:915-919.[Abstract]
24- Schachter J. Chlamydia trachomatis infection :
epidemiology and disease spectrum. Rec Adv Sex Transm
Dis;1986, 3: 39 – 58.

|