|
TRABAJO ORIGINAL
ABLACIÓN QUÍMICA DE LA
VESÍCULA BILIAR CON HIPOCLORITO DE SODIO EN UN MODELO
ANIMAL.
CHEMICAL ABLATION OF THE GALLBLADDER WHIT SODIUM
HYPOCHLORITE IN AN ANIMAL MODEL.
Rafael J. Jover
Clos*, Juan P. Álamo*, Mónica Matsuzaki**, María E. Dionisio
de Cabalier**, Héctor F. Bustos***, Luis Gramatica****
Revista Facultad de Ciencias
Medicas 2011; 68(3):101-106
*Unidad Hospitalaria
de Cirugía Nº 1
**Cátedra de Patología Nº 1
***Cátedra de Radiología Nº 1
****Unidad Hospitalaria de Cirugía Nº 2
Unidad Hospitalaria de Cirugía Nº 1. Hospital Nacional de
Clínicas, Facultad de Ciencias Médicas, Universidad Nacional
de Córdoba. Santa Rosa 1564, (5000) Córdoba, Argentina. TE:
54 351 4337013. Email:
joverclos@hotmail.com
Introducción
Desde mediados de la década del
ochenta (1)
comenzaron a aparecer trabajos
que intentaron lograr una ablación no quirúrgica de la
vesícula biliar (VB). Se han utilizado distintas sustancias
químicas (1-6),
calor (7)
y láser (8).
Estos intentos quedaron relegados con la aparición de la
colecistectomía videolaparoscópica, que se transformó en el
gold standard en el manejo de la litiasis vesicular
(9).
En esta última década se ha retomado la búsqueda de
procedimientos aún menos invasivos, dando lugar a la
aparición, por ejemplo, del NOTES
(10)
y SILS
(11).
Una técnica que se pueda realizar ambulatoriamente con
anestesia local, que no dañe la pared abdominal (y por lo
tanto no genere dolor, alteraciones estéticas ni
restricciones físicas postoperatorias) es el que podrá
competir con la colecistectomía
(12).
A la VB, un órgano hueco, se puede acceder por vía
percutánea (13)
e incluso endoscópica
(14), y eliminar
endoluminalmente la mucosa de la VB. Éste podría ser un
tratamiento alternativo a su resección quirúrgica.
Se propone el uso de hipoclorito de sodio, un álcali con
buena penetración tisular, y la obliteración de la luz
vesicular con cola de fibrina.
Material y métodos
Se trabajó con 30 conejos
neozelandeses macho de 3 a 4 kg, de 4 meses de edad. Se
distribuyeron en tres grupos de 10 animales cada uno.
Procedimiento en todos los conejos: Anestesia: Ketamina (30
mg/kg) y diazepam (3 mg/kg) intramuscular. Cefalotina 20 mg/kg
IM como quimioprofilaxis. Infiltración de la pared con
lidocaína al 2%. Incisión subcostal. Oclusión del conducto
cístico con clamp vascular delicado. Punción de la VB con
Abbocath Nº 18. Aspiración de la bilis.
Grupo A: Se inyectó hipoclorito de reciente titulación a 20
g Cl/l a temperatura ambiente hasta llenar la vesícula.
Luego de 5 minutos, aspiración y reinyección de la solución
(la repetición de la infusión se explica porque el
hipoclorito es inactivado con el contacto prolongado con
sustancias orgánicas). Aspiración luego de otros 5 minutos.
Lavado de la luz vesicular con solución fisiológica.
Aspiración e inyección de cola de fibrina (Tissucol
®
0,5) (Figura 1). Aspiración para colapsar la vesícula y
extracción del clamp.
Grupo B: Inyección de etanol al 95% hasta llenar la
vesícula. Aspiración luego de 10 minutos. Lavado de la luz
vesicular con solución fisiológica. Aspiración e inyección
de cola de fibrina (Tissucol
®
0,5). Aspiración para colapsar la vesícula y extracción del
clamp. Se seleccionó el etanol en este grupo control porque
es el esclerosante más difundido en los trabajos
consultados.
Grupo C: Inyección de solución fisiológica. Aspiración y
cierre con jareta de polipropileno 7/0.
En todos los animales, cierre de la pared abdominal con
surget de poliglactina (Vicryl 2/0). Piel: con surget de
Vicryl 2/0. La duración del procedimiento en todos los
animales fue de 35 minutos aproximadamente. Control de la
evolución postoperatoria. A los 65 días sacrificio del
animal (tiempo suficiente para comprobar si se produjo la
mucoclasia completa y la fibrosis y desaparición de la luz
vesicular), mediante el uso de diazepam (5 mg/kg) IM para
sedación y posterior inyección EV de pentobarbital sódico
(200 mg/kg). Laparotomía mediana, remoción de la vesícula,
tejido hepático adyacente y vía biliar principal para
estudio histológico.
Estudio anatomopatológico: Macroscopia de la pieza
operatoria. Estudio microscópico con coloración de
hematoxilina-eosina. Evaluación de la fibrosis producida,
búsqueda de quistes mucinosos, áreas de reepitelización y de
lesiones en la mucosa de la vía biliar principal.
Análisis estadístico: Test de Fisher comparando el grupo
problema con los dos testigos. Se consideró significativo un
p<0,05. Software utilizado: GraphPad Prism 5.0.3 (GraphPad
Software, Inc., California, USA).
El trabajo fue aprobado por el comité de Bioética del
Hospital Nacional de Clínicas.
Resultados
Un animal murió durante el
procedimiento anestésico, fue reemplazado. No hubo muertes
postoperatorias. Los animales evolucionaron bien, perdiendo
peso los dos primeros días, y a lo largo del mes siguiente
se registró una actividad normal y aumento constante de
peso, hallando todos los animales en óptimo estado al
momento del sacrificio. La cavidad presentó en algunos casos
de todos los grupos adherencias laxas. No se apreció lesión
microscópica en el hígado que rodea a la VB ni en la vía
biliar principal. Se hallaron dos eventraciones, en el grupo
B y en el A.
El 80% de las vesículas tratadas con hipoclorito
desaparecieron dejando una pequeña cicatriz subhepática
(Figuras 2, 3 y 4), en un caso hubo un pequeño remanente
vesicular, con engrosamiento parietal, pero con contenido
biliar y en otros quedó un quiste de retención debido a
mucosa remanente vital con capacidad secretora.
|
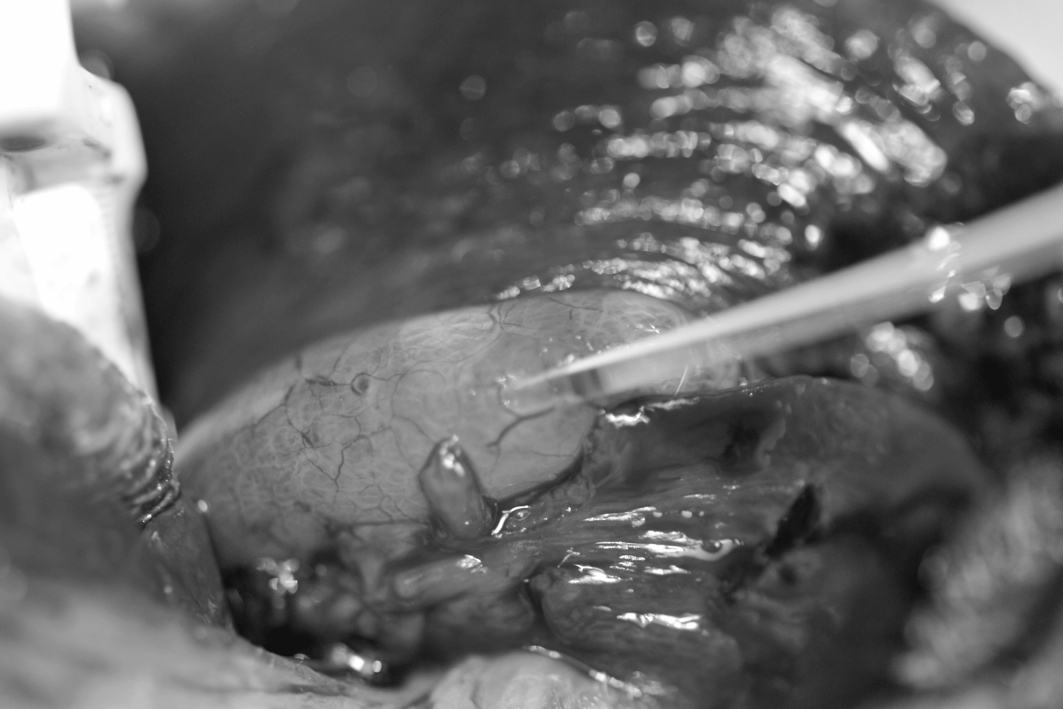 |
Figura 1: Vesícula con el
Abbocath colocado. A la izquierda, el clamp que
obtura el cístico. |
|
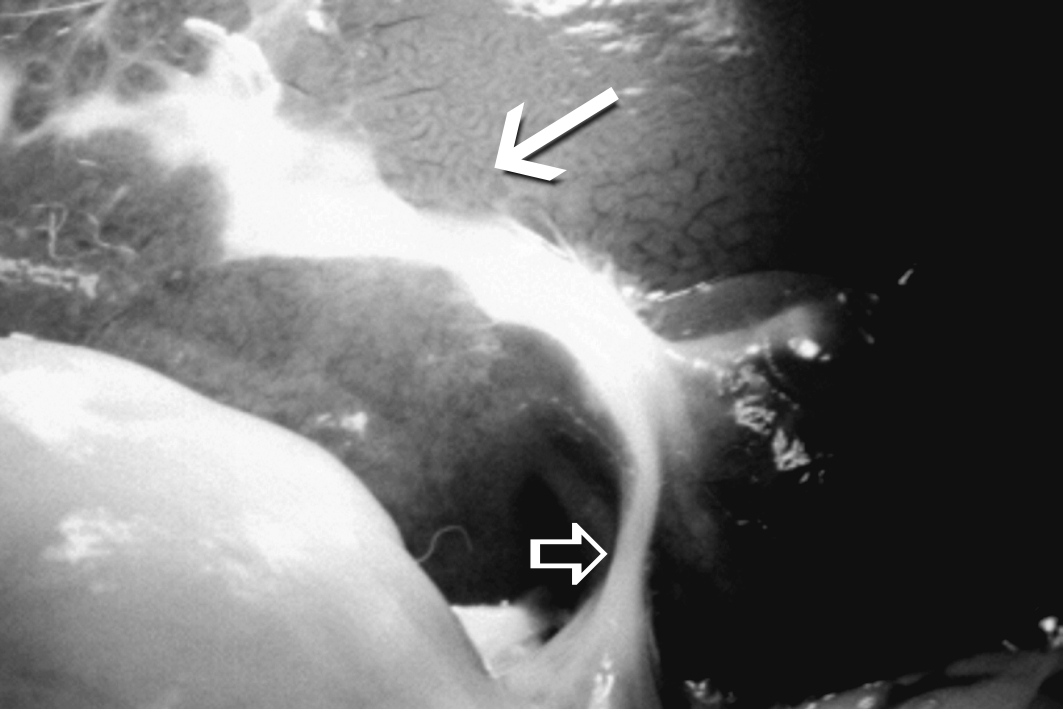 |
Figura 2: Cicatriz subhepática
donde se hallaba la vesícula biliar (flecha
delgada). La flecha gruesa indica la continuidad con
la vía biliar principal. |
|
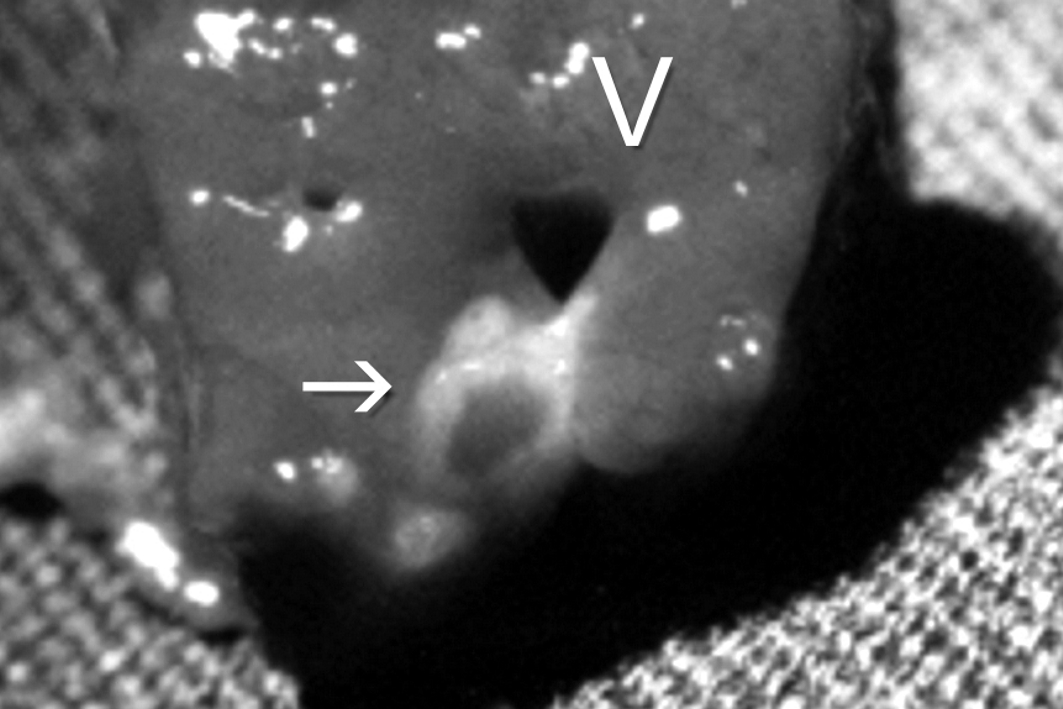 |
Figura 3: Corte transversal
del hígado. La flecha indica el tejido fibroso que
reemplaza a la vesícula. La V marca una vena
suprahepática constante en el lecho vesicular.
|
|
 |
Figura 4: Microfotografía
(hematoxilina eosina, 40X) que muestra tejido
fifroso y ausencia de luz y células epiteliales |
El procedimiento no fue exitoso en un solo caso del grupo
tratado con alcohol, en 5 casos se hallaron quistes y en los
4 restantes quedó un remanente vesicular con conexión
biliar.
El grupo con solución fisiológica, como era de esperar,
mostró sólo adherencias en la zona de la punción y cierre,
con vesículas normales.
La comparación de los resultados demostró una diferencia
significativa favorable al grupo tratado con hipoclorito y
cola de fibrina en comparación con los testigos: solución
fisiológica (p<0,0007) y etanol más cola de fibrina
(p<0,0055).
Discusión
Los cálculos vesiculares se
pueden eliminar disolviéndolos
(15),
destruyéndolos mecánicamente
(4),
con ondas electrohidráulicas
(16)
o con láser
(17).
Incluso hay un trabajo que no se preocupa por los mismos,
realizando la ablación con ellos presentes
(18).
Pero es necesario eliminar el órgano que produce y alberga
la litiasis para evitar la formación de nuevos cálculos
(19).
El principal problema de la mucoclasia es la resistencia y
gran capacidad de regeneración de la mucosa vesicular a
partir de epitelio vital remanente o por la continuidad con
la mucosa del cístico (2).
Cuando queda epitelio sin destruir, se convierte en un foco
de células epiteliales viables que se reproducen y terminan
con la restitución total de la mucosa, o con la formación de
nidos de epitelio que deviene en un mucocele. En el ser
humano, cuya VB posee senos de Aschoff-Rokitansky cubiertos
por epitelio que se introducen en las capas más externas, el
problema es potencialmente mayor
(20).
A pesar de que la VB del conejo no es igual a la vesícula
humana, este animal ha sido usado como modelo en varios
trabajos (1, 21, 22, 23).
Los resultados de diferentes autores son muy variables de
acuerdo a la sustancia utilizada y a los métodos de
obturación del cístico. Salomonowitz, en 36 conejos obturó
el cístico con cianoacrilato y nitrocelulosa, y a cada grupo
problema de 6 animales le inyectó contraste radiológico a
100 ºC, alcohol absoluto, morruato de sodio y la misma
mezcla usada para tapar el cístico. Solo los dos primeros
necrosaron el epitelio y generaron fibrosis. En cinco casos
el tapón se fragmentó, pero fue efectivo
(1).
Lindberg, en sus trabajos con vesículas de cerdo tratadas
previamente con litotripsia mecánica de cálculos
implantados, usó ácido acético, etanol, etanol más
tetradecilsulfato de sodio, solución de Carnoy y contraste
caliente. El cístico fue obturado con ligadura. En la mayor
parte de los casos hubo persistencia de la mucosa
(4, 5).
Lee usó 5 perros, percutáneamente obturó el cístico con
cianoacrilato y coils e inyectó ácido acético. El
tratamiento fue efectivo, aunque en el infundíbulo, en
relación al tapón, quedaron células epilteliales viables
(6).
Getrajdman trabajó con 24 conejos a los que se ligó el
cístico e instiló una mezcla de etanol y ácido
trifluoroacético, logrando un éxito en 22 casos,
atribuyéndole a la completa oclusión del cístico el mayor
mérito por los resultados
(2).
En el presente estudio, la ablación completa se obtuvo en 8
de 10 animales del grupo con hipoclorito, pero hubo
persistencia parcial de la vesícula en 2. El hecho de que
quede mucosa viable puede favorecer la recurrencia de
litiasis (si hay conexión biliar) y eventualmente el
desarrollo de cáncer de VB
(24). Una variación en la
concentración y tiempo de exposición al hipoclorito podría
mejorar el resultado. La combinación de alcohol y cola de
fibrina no fue suficientemente efectiva.
El uso de hipoclorito para la mucoclasia no ha sido
descripto con anterioridad. Es un álcali y un oxidante
indirecto, tiene una mayor penetración cáustica en los
tejidos al no formar escara. Es una sustancia barata,
estéril, que en casos de accidentes podría ser neutralizada
con ácidos débiles. Al ser poco estable debe ser protegida
de la luz y titulada antes de ser usada. En el humano se
conoce su efecto tisular sobre la mucosa esofágica (esofagitis
por cáusticos) (25, 26).
La cola de fibrina ha sido usada para la oclusión de la luz
vesicular y del cístico con éxito
(27).
Conclusiones
En este modelo experimental,
hipoclorito de sodio para eliminar la mucosa vesicular
esclerosar la VB fue seguro y significativamente más
efectivo que el alcohol y la cola de fibrina.
Tras dos décadas de la videolaparoscopia como método de
elección el tratamiento de la litiasis vesicular, hay un
renovado interés por diseñar tratamientos quirúrgicos aún
menos invasivos, llegando incluso al desarrollo de
procedimientos como el NOTES, que requiere anestesia
general, neumoperitoneo, disección de estructuras
vulnerables, apertura del estómago o fondo vaginal, la
adquisición de nuevas destrezas y el desarrollo de costoso
instrumental y aparatología. Puede ser la oportunidad de
retomar el intento de ablación no quirúrgica endoluminal de
la VB.
Referencias
1. Salomonowitz E, Frick MP, Simons RL et al.
Obliteration of the gallbladder without formal
cholecystectomy: a feasibility study. Arch Surg;
1984,119:725-29
2. Getrajdman GI, O'Toole K, Laffey KJ, Martin EC. Cystic
duct occlusion and transcatheter sclerosis of the
gallbladder in the rabbit. Invest Radiol; 1986, 21:400-3
3. Girard MJ, Saini S, Mueller PR, Lee MJ, Ribeiro RE,
Ferrucci JT, Flotte TJ. Percutaneous chemical gallbladder
sclerosis after laser-induced cystic duct obliteration:
Results in an experimental model. Am J Roentgenol; 1992,159:
997-9
Full
Text (pdf)
4. Lindberg CG, Lundstedt C, Jeppsson B, Stenram U,
Stridbeck H. Sclero-therapy for ablation of the gallbladder
after gallstone lithotripsy with a mechanical lithotriptor.
An experimental study in pigs on the effect of absolute
ethanol on edematous gallbladder wall. Acta Radiol;
1991,32:521-3
Pubmed
5. Lindberg CG, Lundstedt C, Jeppsson B, Stenram U,
Stridbeck H. Sclerotherapy of edematous gallbladders with
different agents. An experimental stydy in pigs. Acta Radiol;
1993,34:147-3
Pubmed
6. Lee JH, Won JH, Bae JI, Kim JH, Lee HS, Jung SM. Chemical
ablation of the gallbladder with acetic acid. J Vasc Interv
Radiol; 2009,20:1471-6
Pubmed
7. McGahan JP, Brock JM, Griffey SM, Browning P. A new
method for thermocholecystectomy. Initial experience and
comparison with other techniques. Invest Radiol;
1992,27:947-53
Pubmed
8. Kleiman AS, Panzeri C. Láser-esclerosis experimental de
vesícula biliar. Rev Argent Cirug; 1991,61:253-54
Lilacs
9. Brandon JC, Velez MA, Teplick SK, Mueller PR, Rattner DW,
Broadwater JR Jr, Lang NP, Eidt JF. Laparoscopic
cholecystectomy: evolution, early results, and impact on
nonsurgical gallstone therapies. Am J Roentgenol;
1991,157:235-9
Full text (pdf)
10. Marescaux J, Dallemagne B, Perretta S, Wattiez A, Mutter
D, Coumaros D. Surgery without scars: report of transluminal
cholecystectomy in a human being. Arch Surg; 2007,142:823-6
Full Text (pdf)
11. Edwards C, Bradshaw A, Ahearne P, Dematos P, Humble T,
Johnson R, Mauterer D, Soosaar P. Single-incision
laparoscopic cholecystectomy is feasible: initial experience
with 80 cases. Surg Endosc; 2010,24:2241-7
Pubmed
12. Becker CD, Fache JS, Malone DE, Stoller JL, Burhenne HJ.
Ablation of the cystic duct and gallbladder: Clinical
observations. Radiology; 1990,176:687-90
Pubmed
13. Picus D. Percutaneous gallbladder intervention.
Radiology; 1990,176:5-6
Full Text(pdf)
14. Yamao K, Nakazawa S, Yoshino J, Inui K, Kanemaki N,
Fujimoto M. Peroral cholecystoscopy with a shape-memorizing
alloy catheter. Endoscopy; 1995,27:407
Pubmed
15. Hofmann AF, Amelsberg A, Esch O, Schteingart CD, Lyche
K, Jinich H, Vansonnenberg E, D'Agostino HB. Successful
topical dissolution of cholesterol gallbladder stones using
ethyl propionate. Dig Dis Sci; 1997 ,42:1274-82
Pubmed
16. Chen YK, Nichols MT, Antillon MR. Peroral
cholecystoscopy with electrohydraulic lithotripsy for
treatment of symptomatic cholelithiasis in end-stage liver
disease. Gastrointest Endosc; 2008,67:132-5
Pubmed
17. Takayama S. Percutaneous laser lithotripsy for
gallbladder and common bile duct stones. Surg Laparosc
Endosc Percutan Tech; 2009,19:135-7
Pubmed
18. Kannegieter LS, Brandon JC, Espinoza FP, Vanson DT,
Deutsch LS, Miller DP 3rd, Teplick SK. Gallbladder ablation
with gallstones in situ in an animal model. Invest Radiol;
1993,28:420-6
Pubmed
19. Zou YP, Du JD, Li WM, Xiao YQ, Xu HB, Zheng F, Huang H,
Liu HR, Li HC. Gallstone recurrence after successful
percutaneous cholecystolithotomy: a 10-year follow-up of 439
cases. Hepatobiliary Pancreat Dis Int; 2007,6:199-203
Full Text (pdf)
20. Hall RC, Inman BC, Chen TB, Sobat WS. Gallbladder
ablation: need for a better model. Radiology;
1989,173:578-80
Full Text (pdf)
21. Getrajdman GI, O'Toole K, Laffey KJ, Martin EC. Cystic
duct occlusion and transcatheter sclerosis of the
gallbladder in the rabbit. Invest Radiol; 1986,21:400-3
Pubmed
22. Mahon TG, Wright KC, Armeniades CD. Injection of a
silicone prepolymer system into the gallbladder of rabbits.
Invest Radiol; 1991,26:902-5
Pubmed
23. Majeed AW, Reed MW, Stephenson TJ, Johnson AG. Chemical
ablation of the gallbladder. Br J Surg; 1997,84:638-41
24. So CB, Gibney RG, Scudamore CH. Carcinoma of the
gallbladder: a risk associated with gallbladder-preserving
treatments for cholelithiasis. Radiology; 1990,174:127-30
Pubmed
25. Arévalo-Silva C, Eliashar R, Wohlgelernter J, Elidan J,
Gross M. Ingestion of caustic substances: a 15-year
experience. Laryngoscope; 2006,116:1422-6
Pubmed
26. Riffat F, Cheng A. Pediatric caustic ingestion: 50
consecutive cases and a review of the literature. Dis
Esophagus; 2009,22:89-94
Pubmed
27. Kleiman AS et al. Láser colecistoesclerosis
colecistoscópica: estudio de factibilidad, efectividad y
seguridad en un modelo experimental vivo. Rev argent cir;
2001,80:214-17

|