TRABAJO ORIGINAL
Uso de inmunoglobulina G
humana endovenosa (IGEV) en enfermedades reumáticas
Use of intravenous humana
immunoglobulin in rheumatic diseases
Eduardo D. Mussano, Laura B. Onetti, Isaac I. Cadile
y Carlos M. Onetti
Revista Facultad de Ciencias
Medicas 2012; 69(2):90-96
Servicio de Reumatologia, UHMI 1, Hospital
Nacional de Clínicas.
Facultad de Ciencias Médicas, Universidad Nacional de
Córdoba Santa Rosa 1564, 5000 Córdoba Argentina
edemussano@yahoo.com.ar
Introducción
Las enfermedades reumáticas son un grupo heterogéneo de
patologías de distintas etiopatogenias, clínica y
pronósticos y que responden en forma aleatoria a distintas
terapéuticas, si bien muchas de ellas son tratadas bajo
esquemas de tratamientos consensuados. Ante la
refractariedad con estos últimos, se comienzan tratamientos
con drogas o medicamentos no totalmente convencionales como
es el caso de la inmunoglobulina humana endovenosa (IGEV).
Existen numerosos reportes sobre su uso en distintas
patologías no sólo en enfermedades reumáticas sino también
en inmunodeficiencias primarias (IDP) y secundarias (IDS),
enfermedades autoinmunes (EAI) e inflamatorias sistémicas (ENFSIS),
enfermedades infecciosas y enfermedades alérgicas1,2.
El efecto terapéutico de IGEV se efectúa a través de
distintos mecanismos de acción, según la patología en la que
es empleada3
-Terapia de reemplazo: provee de anticuerpos IgG a aquellos
pacientes que han perdido o que tienen severamente
disminuida la capacidad de producirlos, como en el caso de
IDP e IDS
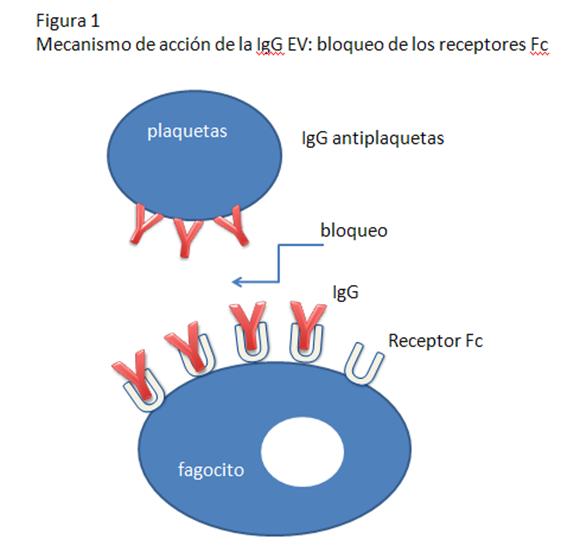
-Bloqueo de los receptores Fc: La IgG se une
inespecíficamente al receptor del FC (FcR) sobre monocitos/macrófagos
o neutrófilos, y bloquea la unión de complejos inmunes tales
como plaqueta-antiplaqueta al FcR (Figura 1).
 |
De: Sisti A, Manfredi MJ:
Inmunoglobulina G Endovenosa: Mecanismos de acción
e indicaciones clínicas. Alerg Inmunol Clin: 2000.
17(4) 168-175 |
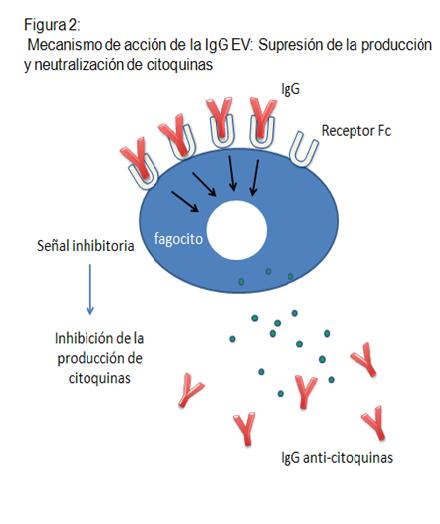
-Supresión de la producción y neutralización de citoquinas:
la IgG, a través de su unión al FcR, genera una señal
intracelular inhibitoria contra el sistema de producción de
citoquinas, y además, los anticuerpos (Ac) anticitoquinas
contenidos en las preparaciones de IGEV, se unen a las
citoquinas directamente, bloqueando la actividad de éstas (Figura
2).
 |
De: Sisti A, Manfredi MJ:
Inmunoglobulina G Endovenosa: Mecanismos de acción
e indicaciones clínicas. Alerg Inmunol Clin: 2000.
17(4) 168-175 |
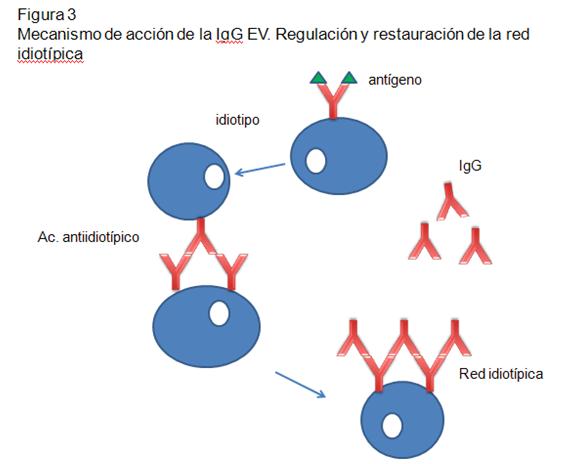
-Regulación idiotipo-antiidiotipo: El fragmento Fab que se
une al Ag (también llamado idiotipo), puede ser reconocido
por el sistema inmune y generar una respuesta con producción
de Ac específicos dirigidos al idiotipo, llamados Ac.
antiidiotipos. Estos Ac. son importantes para la regulación
de linfocitos (L) B y T, ya que pueden unir a las Igs de
superficie del LB y estimular o inhibir la formación
posterior a Ac. De esta misma forma, los Ac antiidiotipo se
pueden ligar a los receptores de la célula T que es
específica para el Ag y regular su actividad. Un Ac
antiidiotipo propio puede suscitar una respuesta inmune y
producir otro Ac con especificidad semejante al idiotipo que
lo estimuló, y así se forman generaciones sucesivas de
idiotipos y antiidiotipos. Esta red idiotípica sería crítica
para la regulación de la inmunidad y también reflejaría una
función inmunomoduladora de los preparados de Gammaglobulina.
La IG EV puede ser un medio para proveer, a los individuos
con autoanticuerpos, la regulación y restauración de la red
antiidiotípica (Figura 3).
 |
De: Sisti A, Manfredi MJ:
Inmunoglobulina G Endovenosa: Mecanismos de acción
e indicaciones clínicas. Alerg Inmunol Clin: 2000.
17(4) 168-175 |
-Atenuación de la respuesta alérgica: Aunque el mecanismo
por el cual la Ig EV puede atenuar la respuesta alérgica es
aún indeterminado, existen varios por los cuales podrá
modular las respuestas mediadas por IgE, por ejemplo
haciendo disminuir la diferenciación de células B con
disminución de IgE, otro mecanismo seria bloquear la IgE en
su unión a las células. Además podría actuar disminuyendo la
sensibilidad órgano-blanco. Habría otros varios mecanismos
propuestos3.
El objetivo de este trabajo es presentar una casuística del
uso de IGEV en distintas enfermedades reumáticas.
Pacientes y métodos
Se estudiaron en forma retrospectiva 13 pacientes que
concurrieron al Servicio de Reumatología del Hospital
Nacional de Clínicas (Córdoba, Argentina); 10 de sexo
femenino (77%) y 3 de sexo masculino (23%) con una edad
media de 30,3 años, que padecían de distintas enfermedades
reumáticas. Por refractariedad a tratamientos convencionales
(esteroides, DMARs e inmunosupresores), se les hicieron
pulsos de IG EV para tratar de lograr mejoría o remisión de
su cuadro clínico previo.
La IGEV utilizada en nuestro medio es producida por el
Laboratorio de Hemoderivados de la Universidad Nacional de
Córdoba, Argentina, que procesa plasma de donantes
voluntarios. El producto final es una Inmunoglobulina G
liquida al 5% para aplicación endovenosa, polivalente y
policlonal que se presenta en frascos de 0,5; 2,5;5.0 y 10
gramos respectivamente4.
De los pacientes reclutados para este trabajo 6/13 cumplían
con diagnóstico de lupus eritematoso sistémico (LES) ACR
1997, 2/13 síndrome antifosfolípido primario (SAF 1º) Wilson
1999; y 1 caso de polidermatomiositis (DPM), 1 artritis
crónica juvenil (ACJ), 1 panarteritis nodosa cutánea (PAN
cutánea) ACR 1990, un paciente con síndrome de Evans (SE) y
un paciente con uveítis autoinmune (UA).
La tabla 1 muestra los datos demográficos de los pacientes ,
donde se observa la distribución de los mismos por edad,
sexo, patología por la cual fue tratado y tiempo de
evolución de la misma al momento del tratamiento; mientras
que en la Tabla 2 se observa el motivo por el cual se decide
medicar con IG EV, la cantidad de pulsos de IG EV que
recibió cada paciente y la dosis que variaban entre 400
mg/kg y 600 mg/kg por pulso en forma diaria con un mínimo de
3 y un máximo de 6 pulsos. Se trabajó con personal
calificado y bajo estrictas medidas de asepsia en cada
infusión. Es un trabajo descriptivo en el que se estudiaron
las frecuencias de las respuestas positivas o no a la
terapia instituida.
|
Pacientes |
edad |
sexo |
patología |
Tiempo de evolución (meses) |
|
Nro |
|
1 - P.J. |
17 |
F |
S. de Evans |
12 |
|
2 - B.N. |
19 |
F |
SAF 1º |
3 |
|
3 - J.M. |
35 |
F |
PAN cutánea |
24 |
|
4 - A.H. |
27 |
M |
SAF 1º |
8 |
|
5 - G.J.J. |
63 |
M |
DPM |
72 |
|
6 - A.N. |
17 |
F |
LES |
36 |
|
7 - P.M. |
19 |
F |
LES + SAF |
7 |
|
8 - L.F. |
42 |
M |
Uveítis
autoinmune |
8 |
|
9 - O.N. |
35 |
F |
LES |
36 |
|
10- M.L. |
26 |
F |
ACJ |
5 |
|
11- S.J. |
26 |
F |
LES + SAF |
6 |
|
12 - A.P. |
24 |
F |
LES |
48 |
|
13 - F.E. |
44 |
F |
LES+Paniculitis |
8 |
|
|
Pte* |
Indices de |
Dosis |
Pulsos** |
|
gravedad |
mg/kg |
|
1 |
Trombopenia |
400 mg |
5 |
|
2 |
Trombopenia |
400 mg |
5 |
|
3 |
Progresión de
lesiones |
500 mg |
6 |
|
4 |
Trombopenia |
400 mg |
5 |
|
5 |
Miositis severa |
500 mg |
4 |
|
6 |
S. nefrótico |
500 mg |
3 |
|
7 |
Vasculitis + |
400 mg |
4 |
|
trombopenia |
|
8 |
Progresión de
lesiones |
600 mg |
5 |
|
9 |
Dermatitis
severa |
400 mg |
5 |
|
10 |
Vasculitis + |
500 mg |
5 |
|
trombopenia |
|
11 |
Trombopenia |
400 mg |
5 |
|
12 |
Dermatitis
severa + GNDRP |
400 mg |
4 |
|
13 |
Paniculitis |
400 mg |
5 |
|
lúpica |
|
| Tabla
I: Datos demográficos |
Tabla II:
Indicación del tratamiento con IG EV |
Resultados
Del total de 13 pacientes ,7 de ellos tuvieron una respuesta
positiva a la terapia con IGEV evaluada por parámetros
clínicos (disminución de las lesiones dérmicas y de la
paniculitis; mejoría de la fuerza muscular,) parámetros
bioquímicos (aumento del número de plaquetas, disminución de
la creatinfosfokinasa y LDH, mejoría de la función renal y
del sedimento urinario). Esta mejoría se evaluó y prolongó
por un término de 24 meses. Durante ese tiempo los pacientes
quedaron con tratamientos convencionales (esteroides e
inmunosupresores p.o.). Una paciente recibió dentro de los
24 meses nuevo pulso de IG EV por reactivación de su
paniculitis lúpica. Por otro lado, en los otros 6 pacientes
se consideró que hubo fracaso terapéutico con la IGEV, ya
que la respuesta clínica y bioquímica fue pobre en 4 de
ellos y 2 pacientes fallecieron dentro del mes del último
pulso, 1 por hemorragia pulmonar masiva y otro por sepsis (Tabla
3).
No se registraron reacciones adversas durante las infusiones
excepto cefaleas y náuseas en 2 de los 13 pacientes.
|
paciente |
Evolución |
efectos colaterales |
|
1 |
mala |
No |
|
2 |
muy buena |
No |
|
3 |
† (sepsis) |
|
|
4 |
buena |
No |
|
5 |
muy buena |
No |
|
6 |
mala |
No |
|
7 |
†* (HPM) |
|
|
8 |
muy buena |
No |
|
9 |
buena |
No |
|
10 |
muy buena |
No |
|
11 |
mala |
No |
|
12 |
mala |
No |
|
13 |
muy buena |
No |
|
Tabla III: Eficacia
terapéutica
† Paciente fallecido
* Hemorragia pulmonar masiva
Evolución:
Mala = fracaso terapéutico
Buena = mejoría clínica y de
laboratorio
parcial
Muy buena = mejoría clínica y
de laboratorio completa
|
Discusión
Los objetivos terapéuticos para las enfermedades reumáticas
se encuentran establecidos y consensuados en la mayoría de
estas. No obstante, la respuesta terapéutica no es siempre
satisfactoria y se debe recurrir a otro tipo de tratamientos
como es el caso de la IGEV (ya totalmente aceptada en
Kawasaki y Púrpura trombocitopénica idiopática (PTI). Hace
ya casi 50 años se comenzaron a ensayar terapias
inmunomoduladoras usando IG obtenida de plasma5 y, más
específicamente, el efecto beneficioso de la infusión con
altas dosis de IGEV en niños con PTI fue informado por
Imbach y col.6,7,8 y luego confirmado por otros
investigadores. Así mismo, en la enfermedad de Kawasaki
presentó una respuesta terapéutica positiva con IGEV según
los primeros trabajos presentados por Newburger en 19869.
También sugieren que la IGEV puede ser beneficiosa e inocua
para diversas manifestaciones del LES. Después de una
cuidadosa revisión de publicaciones realizadas entre1983 y
2005 se reportan las diversas manifestaciones clínicas del
LES que fueron exitosamente tratadas con IGEV y que
incluyeron la anemia hemolítica autoinmune, los inhibidores
adquiridos del factor VIII, la enfermedad de von Willebrand
adquirida, la aplasia de células rojas, trombocitopenia,
pancitopenia, nefritis, enfermedad renal terminal,
neuropatías y psicosis y vasculitis La experiencia más
extensa ha sido con la nefritis lúpica. El índice de
respuesta a la terapéutica IGEV varió entre un 33 a un 100%.
Los autores sugieren que la IGEV desprovista de sucrosa, en
una dosis de 400mg/ kg/día en un período de 5 días y en un
índice de infusión lenta sin un riesgo aumentado de eventos
tromboembólicos o insuficiencia renal, es una terapéutica
adyuvante y beneficiosa para los casos de LES que son
resistentes o que presentan secundarismos importantes al
tratamiento convencional10,11,12,13.
También, una alternativa para el tratamiento del lupus
eritematoso cutáneo subagudo y de la paniculitis lúpica, es
el uso de la IGEV14,15,16. En muchos casos esta
afección parece ser resistente a diversos tratamientos
sistémicos o tópicos. En nuestros pacientes la respuesta fue
disímil, excepto en el caso de paniculitis donde la paciente
experimentó una excelente respuesta a sus lesiones,
continuando su tratamiento con hidroxicloroquina 400mg/día y
prednisona 5 mg/día. Esta paciente necesitó un nuevo pulso
con IGEV un año después de la primera terapéutica por
recurrencia donde también se observó muy buena respuesta.
Si bien no hay mayor información sobre el uso de IGEV en PAN
cutánea si existen reportes del beneficio de su aplicación
en panarteritis nodosa17 y otras vasculitis asociadas a
ANCA con resultados positivos18, dejando entonces una
puerta abierta para el tratamiento de estas enfermedades
vasculares muchas veces refractaria a otros inmunosupresores
o esteroides a dosis altas.
Dos casos de LES con síndrome antifosfolípidos fueron
incluidos en este trabajo por falta de respuesta a
tratamientos convencionales y gravedad del cuadro. Dado que
existen evidencias que la IGEV reduce en forma importante
los niveles de anticuerpos anticardiolipinas en muchos de
estos enfermos, tal como lo demuestra Krause en un trabajo
con Lupus y síndrome antifosfolípido19. En ninguno de
estos pacientes (P) la reacción fue favorable, incluso uno
de ellos falleció antes del 5º ciclo por hemorragia pulmonar
masiva (P7)
En cambio, 2 pacientes con SAF primario en los cuales la
trombopenia se volvió refractaria y con alto riesgo de
sangrado y tomando como referencia experiencias previas como
la de Shoenfeld y col20 respondieron muy bien a la terapia
con IGEV mejorando sensiblemente la trombopenia asociada a
su enfermedad de base quedando solamente con anticoagulación
permanente.
En el síndrome de Evans existen, sin embargo, varios
reportes sobre los beneficios del uso de la IGEV ante
cuadros refractarios a esteroides, o cuadro severos donde se
evalúa de como terapéutica de primera línea21,22.
Lamentablemente en nuestro único paciente con síndrome de
Evans y trombopenia severa no se obtuvieron buenos
resultados después de 5 pulsos de IGEV. Quizás en este
paciente la terapéutica conjunta con ciclofosfamida podría
haber cambiado la evolución del cuadro.
Otro uso de la IGEV ha sido como terapia combinada en niños
o adolescentes con artritis crónica juvenil. Un caso de una
joven de 26 años con una enfermedad de 14 años de evolución
con vasculitis severa de ambos miembros inferiores y
trombopenia. Se comenzó con IGEV, mejorando ostensiblemente
después del 5ª pulso ambas manifestaciones, pasando a
tratamiento de mantenimiento con azatioprina. Hay varios
estudios al respecto con resultados disimiles según motivo
de indicación de la IGEV en artritis crónica juvenil, pero
no deja de ser una opción válida ante fracasos terapéuticos
con drogas convencionales23,24,25,26.
En un paciente varón con dermatopolimiositis severa, con
alta sospecha de ser de origen neoplásico por la
refractariedad del cuadro a tratamientos convencionales con
esteroides a altas dosis, metotrexato y azatioprina, se
obtuvo una respuesta óptima después de 4 pulsos con IGEV.
Existen reportes respecto de su uso exitoso en forma de
monoterapia como así también asociada al mofetil
micofenolato en casos de miositis severa27,28,29
El uso de IGEV en enfermedades inflamatorias oculares y
especialmente en aquellas de origen autoinmune ha sido
relatado por varios autores30. En el único caso de
uveítis autoinmune en un paciente de 42 años con progresión
de las lesiones oculares y pérdida progresiva de la visión,
hubo una muy buena respuesta después del 5º ciclo y a altas
dosis de IGEV (600 UI kg/dosis). El paciente continuó con
dosis de 2mg/kg por día de tacrolimus y ciclosporina A
local.
Se concluye que la terapia con IG EV es una opción valedera
y efectiva para algunas patologías autoinmunes como la
enfermedad de Kawasaki y PTI, pero en otras enfermedades
reumáticas el margen de éxito terapéutico es limitado. Si
bien sólo el 55 por ciento de nuestros pacientes tuvieron
una respuesta clínica positiva, es una posibilidad de
tratamiento útil, considerando que hubo fracaso terapéutico
previo en todos ellos.
Bibliografia
1. Danieli MG, Calcabrini L, Marchetti A, Calabrese V,
Pettinari L, Massaccesi C, Gabrielli A, Danieli G.
Intravenous immunoglobulin treatment in autoimmune diseases.
Recenti Prog Med. 2007; 98(6):322-6
2. Nydegger U. Old and current aspects of intravenous
immunoglobulin therapy. Schweiz Med Wochenschr: 1994 Jan
11;124(1-2):5-25
PubMed
3. Sisti A, Manfredi MJ: Inmunoglobulina G Endovenosa:
Mecanismos de acción e indicaciones clínicas. Alerg Inmunol
Clin: 2000. 17(4) 168-175
Abstract
4. Sisti A, Vitali MS, Zarzur J, Ma fredi MJ.
Inmunoglobulina G Endovenosa; características de un
medicamento elaborado en la Argentina. Arch Arg. Alergia
Inmunol. Clínica: 2000; 31:4:115-124.
5. Rewald E, Suringar F. Tolerance of Intravenous Gamma
Globulin. Proc. 11 th Congress Int. Soc. Blood Transf.
Sydney 1966.Bibl Haematol Karger, Basel/New York, 1968, p
33-9.
PubMed
6. Imbach P, Wargner HP, Berthold W et al. Intavenous
immunoglobulin versus oral corticosteroids in acute immune
thrombocytopenic purpura in childhood. Lancet: 1985;
2:464-8.
PubMed
7. Sherer Y, Levy Y, Fabbrizzi F, Shoenfeld Y. Treatment of
hematologic disorders other than immune thrombocytopenic
purpura with intravenous immunoglobulin (IVIg) - report of
seven cases and review of the literature.Eur J Intern Med:
2000 Apr ; 11(2):85-88.
PubMed
8. Go RS, Johnston KL, Bruden KC. The association between
platelet autoantibody specificity and response to
intravenous immunoglobulin G in the treatment of patients
with immune thrombocytopenia.Haematologica: 2007 Feb;
92(2):283-4.
Full Text
9. Newburger JW, Takahashi M, Bums JC, et al. The treatment
of Kawasaki syndrome with intravenous gamma globulin. N Engl
J Med: 1986; 315: 341-347.
PubMed
10. Sherer Y, Kuechler S, Jose Scali J, Rovensky J, Levy Y,
Zandman-Goddard G, Shoenfeld Y. Low dose intravenous
immunoglobulin in systemic lupus erythematosus: analysis of
62 cases. Isr Med Assoc J: 2008 Jan;10 (1):55-7.
Full Text
11. Levy Y, Sherer Y, Ahmed A, Langevitz P, George J,
Fabrizzi F, Terryberry J, Meissner M, Lorber M, Peter JB,
Schoenfeld Y. A study of 20 patients with intravenous
immunoglobulin-clinical and serologic response. Lupus: 1999;
8(9):705-12.
Full
Text
12. Sherer Y, Shoenfeld Y. Intravenous immunoglobulin for
immunomodulation of systemic lupus erythematosus.Autoimmun
Rev: 2006 Feb; 5(2):153-5.
PubMed
13. Winder A, Molad Y, Ostfeld I, et al: Treatment of
systemic lupus erithematosus by prolonged administration of
high dose intravenous immunoglobulin: report of two cases. J
Rheumatol: 1993; 20: 795.
PubMed
14. Espírito Santo J, Gomes MF, Gomes MJ, Peixoto L, C
Pereira S, Acabado A, Freitas J, de Sousa GV. Intravenous
Immunoglobulin in Lupus Panniculitis. Clin Rev Allergy
Immunol. 2009 Jun 27.PubMed
15. Lampropoulos CE, Hughes GR, D' Cruz DP. Intravenous
immunoglobulin in the treatment of resistant subacute
cutaneous lupus erythematosus: a possible alternative.Clin
Rheumatol. 2007 Jun;26 (6):981-3.
PubMed
16. Goodfield M, Davison K, Bowden K. Intravenous
immunoglobulin (IVIg) for therapy-resistant cutaneous lupus
erythematosus (LE).J Dermatolog Treat. 2004 Jan;15(1):46-50.
PubMed
17. Asano Y, Ihn H, Maekawa T, Kadono T, Tamaki K. High-dose
intravenous immunoglobulin infusion in polyarteritis nodosa:
report on one case and review of the literature. Clin
Rheumatol. 2006 May;25 (3):396-8.
PubMed
18. Martinez V, Cohen P, Pagnoux C, Vinzio S, Mahr A,
Mouthon L, Sailler L, Delaunay C, Sadoun A, Guillevin L;
French Vasculitis Study Group. Intravenous immunoglobulins
for relapses of systemic vasculitides associated with
antineutrophil cytoplasmic autoantibodies: results of a
multicenter, prospective, open-label study of twenty-two
patients. Arthritis Rheum 2008 Jan; 58 (1):308-1
PubMed
19. Krause I, et al. Abrogation of experimental sistemic
lupus erythematosus and primaria antiphospholipid syndrome
with intravenous gammaglobulin. J Rheumatol. 1995;
22:1068-7.
20. Bakimir R, Guilburd B, Zurgil N, Schoenfeld Y. The
effect of intravenous gammaglobulin on the induction of
experimental antiphospholipid syndrome. Clin. Inmunol.
Inmunopathol 1993; 69:97-102.
PubMed
21. Bianco D, Hardy RM. Treatment of Evans' syndrome with
human intravenous immunoglobulin and leflunomide in a
diabetic dog.J Am Anim Hosp Assoc. 2009 May-Jun;45
(3):147-50.
PubMed
22. Bolis S, Marozzi A, Rossini F, Casaroli I, Pogliani EM,
Corneo G. High dose intravenous immunoglobulin (IVIgG) in
Evans' syndrome. Allergol Immunopathol (Madr). 1991 Sep-Oct;
19 (5):18.
23. Shaĭkov AV, Kuznetsova IO, Movsisian GR. Intravenous
immunoglobulin in combined therapy for children with
juvenile rheumatoid arthritis (evaluation of therapeutical
efficiency and factors that influence them) Vestn Ross Akad
Med Nauk. 1998; (12):36-9.
PubMed
24. Giannini EH, Lovell DJ, Silverman ED, Sundel RP, Tague
BL, Ruperto N. Intravenous immunoglobulin in the treatment
of polyarticular juvenile rheumatoid arthritis: a phase I/II
study. Pediatric Rheumatology Collaborative Study Group.J
Rheumatol. 1996 May;23 (5):919-24.
PubMed
25. Uziel Y, Laxer RM, Schneider R, Silverman ED.
Intravenous immunoglobulin therapy in systemic onset
juvenile rheumatoid arthritis: a followup study.J Rheumatol.
1996 May;23 (5):910-8.
PubMed
26. Silverman ED, Cawkwell GD, Lovell DJ, Laxer RM, Lehman
TJ, Passo MH, Zemel LS, Giannini EH. Intravenous
immunoglobulin in the treatment of systemic juvenile
rheumatoid arthritis: a randomized placebo controlled trial.
Pediatric Rheumatology Collaborative Study Group.
PubMed
27. Danieli MG, Calcabrini L, Calabrese V, Marchetti A,
Logullo F, Gabrielli A.Intravenous immunoglobulin as add on
treatment with mycophenolate mofetil in severe myositis.
Autoimmun Rev. 2009 Apr 19.
PubMed
28. Barbasso Helmers S, Dastmalchi M, Alexanderson H,
Nennesmo I, Esbjörnsson M, Lindvall B, Lundberg IE.. Limited
effects of high-dose intravenous immunoglobulin (IVIG)
treatment on molecular expression in muscle tissue of
patients with inflammatory myopathies Ann Rheum Dis. 2007
Oct;66 (10):1276-83.
Full Text
29. Williams L, Chang PY, Park E, Gorson KC, Bayer-Zwirello
L. Successful treatment of dermatomyositis during pregnancy
with intravenous immunoglobulin monotherapy.Obstet Gynecol.
2007 Feb;109:561-3.
PubMed
30. Pras E, Neumann R, Zandman-Goddard G, Levy Y, Assia EI,
Shoenfeld Y, Langevitz P. Intraocular inflammation in
autoimmune diseases. Semin Arthritis Rheum. 2004
Dec;34(3):602-9.
PubMed
|