TRABAJO ORIGINAL
Miopatías inflamatorias
idiopática: su asociación a hepatopatías
Idiophatic inflammatory myophaties: its asociation
with liver disorders
Schneeberger EE1, Arriola MS1, Fainboim H2,
Schroder Teresa2, González J3, Baiges D2, Luque M, Maldonado
Cocco JA1, Citera G1.
Revista Facultad de Ciencias
Medicas 2012; 69(3):139-143
1-Sección
Reumatología, Instituto de Rehabilitación Psicofísica, BA .
2-Unidad
de Hepatopatías Infecciosas, Hospital “ Dr Muñiz”, BA .
3-
Laboratorio Inmunología, Hospital Muñiz, BA. Servicio de
Hepatitis y Gastroenteritis INEI-ANLIS “Dr C Malbrán”.
Introducción
Las miopatías inflamatorias idiopáticas (MII) son un grupo
de enfermedades de causa desconocida que se caracterizan por
la inflamación crónica de los músculos esqueléticos. Estas
incluyen la polimiositis (PM), la dermatomiositis (DM), las
miositis por cuerpos de inclusión (MCI) y la miositis en
superposición con cáncer u otra enfermedad del tejido
conectivo (ETC)1. En estas enfermedades, las enzimas
musculares,suelen elevarse como consecuencia de los
episodios de injuria muscular.1 Entre las enzimas
musculares se encuentran la creatinfosfoquinasa (CPK), la
lactico deshidrogenasa (LD), la aldolasa y la
aspartatoaminotransferasa (TGO).1 Por otro, lado, las
aminotransferasas, TGO y alaninoaminotransferasa (TGP) son
indicadores sensibles de daño hepático. La TGO además de
presentar una alta concentración en el hígado se encuentra
también en otros órganos y tejidos como corazón, músculo
esquelético, riñones, cerebro, páncreas, pulmones,
leucocitos y eritrocitos.2 Sin embargo, la TGP es
principalmente producida por los hepatocitos, por lo cual es
considerada una enzima hepato específica y su elevación
sérica es principalmente atribuida a injuria
hepatocelular.2,3 En la práctica diaria, puede observarse la
frecuente elevación de la TGP, en forma concomitante con las
enzimas musculares en los pacientes con miopatías
inflamatorias. Una cuidadosa revisión de la literatura
demuestra que la TGP no debería ser considerada como
hepato específica, ya que la elevación de la misma puede
deberse a otras condiciones clínicas, principalmente,
injuria muscular.3 Por otro lado, existen reportes en la
literatura que sugieren la asociación de MII con hepatitis
virales. Se han descripto varios casos de pacientes con
dermato-polimiositis (DM/PM) e infección por virus de
hepatitis C (HCV), interpretando que la respuesta inmune a
la infección por HCV o el HCV por sí mismo podrían jugar un
rol importante en la patogénesis de estas enfermedades4-8.
Por este motivo, decidimos determinar la frecuencia de
alteración del hepatograma en pacientes con miopatías
inflamatorias idiopáticas, evaluar posibles hepatopatías
asociadas como esteatosis hepática, infecciones por virus de
hepatitis B y C, hepatitis autoinmunes u otro desorden
asociado, determinar su relación con la elevación de las
enzimas musculares y establecer si estos pacientes presentan
algún rasgo clínico y/o serológico particular.
Material y métodos
Realizamos un estudio durante los años 1999-2000, en el cual
incluimos en forma consecutiva pacientes mayores de 16 años
con diagnóstico de DM/PM según criterios de Bohan y Peter 9,
que acudieron al consultorio de Reumatología del Instituto
de Rehabilitación Psicofísica. Se excluyeron pacientes con
miopatías asociadas a neoplasias, otra enfermedad del tejido
conectivo (ETC) o enfermedad hepática conocida previa al
comienzo de la miopatía. Se consignaron datos demográficos,
características de la enfermedad, tiempo de evolución,
tratamientos recibidos y elevación de las enzimas hepáticas
y musculares durante el transcurso de la enfermedad. A todos
los pacientes se les realizó un interrogatorio
predeterminado que incluyó características sociodemográficas
y hábitos tóxicos, examen físico y exámenes de laboratorio
(hemograma, eritrosedimentación -ERS-, enzimas musculares,
hepatograma, función renal, proteinograma y orina completa).
Se efectuaron test serológicos para hepatitis virales: HBsAg,
anti HB coreIgG yanti HBs por ELISA de 2da generación, anti
HCV por ELISA de 3ra generación (ABBOTT), ADN-HBV y ARN-HCV
por PCR RT-nested (in house). Determinación de
autoanticuerpos: anticuerpos antinucleares (ANAs) usando como
sustrato HepII, anticuerpo anti músculo liso (ASMA),
anticuerpos antimitocondriales (AMA) y anticuerpos
Liver Kidney Microsomal(LKM) utilizando como sustrato
arrollado de ratón y anticuerpos específicos de miositis SMA
por ELISA. A aquellos pacientes que tenían alteración del
hepatograma se les realizó ecografía hepática por un médico
hepatólogo experimentado. Se consideró la posibilidad de
punción biopsia hepática (PBH) en caso de positividad de
HBsAg o anti HCV confirmado con RNA-HCV positivo y/o
sospecha de hepatitis autoinmune. La prevalencia de hepatitis
B y C en la población general fue estimada en un grupo de
donantes sanos. Para el análisis estadístico, se realizó
estadística descriptiva, las variables categóricas fueron
comparadas por test exacto de Fisher y las variables
numéricas fueron comparadas por test de Mann Whitney.
Resultados
Se incluyeron 27 pacientes, de los cuales 22 tenían datos
suficientes para el análisis. Diez pacientes reunían
criterios para DM, 9 para PM, 1 para DM/PM juvenil y 2 para
miositis por cuerpos de inclusión. La edad media de los
pacientes fue de 47.95 años ± 16, 18 de sexo femenino
(81.8%) y tiempo medio de evolución 8.09 años ± 5.6. Los
datos clínicos se detallan en la Tabla I.
  |
Tabla I. Características clínicas de
22 pacientes con DM/PM
|
Los tratamientos
recibidos por los pacientes eran esteroides en 22 (100%),
metotrexato 16 (72.7%), azatioprina en 4 (18.2%),
ciclofosfamida en 2 (9.1%) y gammaglobulina en 1 (4.5%). En
cuanto a los resultados de laboratorio17/22 pacientes
(77.3%) tenían creatinfosfoquinasa(CPK) elevada, 10
pacientes láctico deshidrogenasa (LDH) elevada y 7 aldolasa
elevada durante el curso de la enfermedad. Con respecto a
las enzimas hepáticas,14/22 pacientes (63.3%) presentaron
TGP elevada y 11/22 (50%) TGO elevada, de estos pacientes
también 10 presentaban concomitantemente TGP elevada y 1
solo TGO elevada aislada, mientras que 4 pacientes tenían
sólo aumento de la TGP.Solo 3 pacientes (14.3%) presentaron
fosfatasa alcalina (FAL) elevada. 5 pacientes (25%) tenían
hipoalbuminemia y 7 (36.8%) hipergammaglobulinemia. En los
catorcepacientes con alteraciones del hepatograma (elevación
de TGO y/o TGP) se realizó ecografía abdominal y en 66.7% de
ellos (10/15) se encontraron anormalidades, 8 pacientes
tenían hiperecogenicidad del parénquima hepático, 4 litiasis
vesicular y en 1 paciente se halló hepatomegalia. Ningún
paciente presentó portación de HBV o de HCV. El HBsAg fue
negativo en todos los pacientes. Tres pacientes presentaron
anti HB coreIgG positivo, de los cuales uno sólo tenía anti-HBs
positivo y en los restantes 2 pacientes ADN-HBV PCR fue
negativa. En cuanto al virus C, sólo 1 paciente fue positivo
para anti-HCV, pero la prueba confirmatoria con ARN-HCV PCR
fue negativa. La prevalencia de serología para hepatitis a
virus B en donantes sanos fue 1.24% para HBsAg, 2.5% para
anti HBc y 0.79% para anti HCV, observándose una frecuencia
significativamente mayor de anti core y de anti-HCV en
nuestros pacientes que en los controles sanos (9.1% vs 2.5%,
p=0.001 y 4.5% vs 0.79%, p=0.0001). En 14 pacientes (63.6%)
los ANAS fueron positivos y se detectaron autoanticuerpos
vinculados a autoinmunidad hepática en tan sólo dos
pacientes, un paciente tenía ASMA positivo en título de 1/60
y AMA positivo. Esta paciente tenía elevación persistente de
enzimas hepáticas y alteraciones en la ecografía pero no se
pudo realizar biopsia hepática porque falleció a causa de
una neumonía. El perfil de los autoanticuerpos detectados se
resume en la Tabla II.
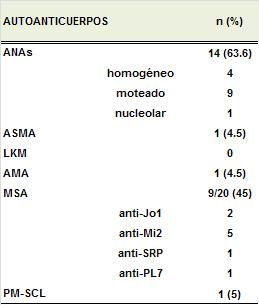  |
Tabla II.
Autoanticuerpos en 22 pacientes con DM/PM |
Los MSA se detectaron en 9 de 20
sueros disponibles (45%) (Tabla 2). Los 8 pacientes con
hiperecogenicidad hepática coinciden con ascenso de TGP/TGO
en el hepatograma. En cuanto a los 10 pacientes que tenían
elevación de ambas enzimas hepáticas (TGP y TGO), solo un
caso podría ser explicados por hepatopatía (paciente con
ASMA +). A pesar de ello en los 15 casos estudiados las
elevaciones de TGP y/o TGO coincidieron con los brotes de
miositis y siguieron un patrón semejante a la CPK,
encontrando además aparente hepatopatía concomitante en
tansólo 9 de ellos. (Gráfico I). Los pacientes TGP y/o TGP y
TGO elevada no mostraron ningún rasgo clínico y/o serológico
en particular comparado con aquellos que tenían solo
elevación de TGO y otras enzimas musculares.
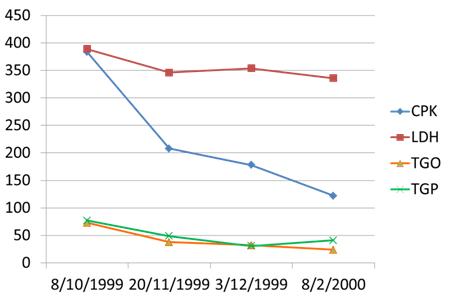  |
Gráfico I. Elevación de TGO/TGP
concomitante con la brotes de miositis
CPK VN. h195 Ul/l
LDH VN: h224 Ul/l
TOG VN: h38 Ul/l
TGP VN: 40 Ul/l
|
Discusión
En nuestro grupo de pacientes estudiados hallamos una
elevación de las transaminasas TGP y TGO, en 63.3% y en 50%,
respectivamente. Cabe destacar, que en todos los casos con
TGO y/o TGP aumentada, las enzimas musculares estudiadas
también estaban concomitantemente elevadas y sólo en 9/11
pacientes se encontró una probable hepatopatía asociada
(1 paciente con probable hepatitis autoinmune y 8 con hiperecogenicidad hepática). El hallazgo más frecuente de la
elevación de TGP con respecto a la elevación de la TGO,
podría explicarse por su vida media más prolongada de 47
horas vs 17 hs para la TGO.10
El patrón de hiperecogenicidad hepática puede ser compatible
con esteatohepatitis, a pesar que estos 8 pacientes también
presentaban elevaciones de otras enzimas musculares en forma
concomitante. En nuestro estudio ninguno de los pacientes
era alcohólico. La esteatohepatitis no alcohólica es el
motivo más común de elevación asintómatica de
aminotransferasas.11 Si bien, las causas de esteatohepatitis
no alcohólica son variadas, las más frecuentes son las
hiperlipidemias, la obesidad, la diabetes tipo II y las
drogas (glucocorticoides, metotrexato, etc) 11En esta
afección hepática la relación TGO:TGP suele ser menor a
11,12 compatible con nuestros hallazgos de laboratorio.
Lamentablemente, la determinación del diagnóstico y de la
severidad de esteatohepatitis no alcohólica requiere de
biopsia hepática2,10, y en nuestro estudio no realizamos
PBH a estos pacientes, no pudiendo diferenciar entre la
presencia de esteatosis hepática y esteatohepatitis.
Encontramos mayor prevalencia de anti-HB core en comparación
a la población control, y los tres pacientes con anti-HBc
podrían ser interpretados como infección pasada por virus
hepatitis B, ya que uno fue anti-HBs positivo y los dos
restantes tenían anti-HBc positivo aislado con ausencia de
ADN viral. En el caso del paciente anti-HCV, pudo tratarse
de un falso positivo, ya que la infección fue descartada por
la prueba PCR-ARN viral. Con respecto a este punto, varios
autores han detectado probable asociación de las MII con
hepatitis C4-8,sin embargo hay pocos reportes de asociación
con virus B12-14. El mayor número de pacientes con esta
asociación fue observada por Ayabe M, et al que encuentraron
serología positiva para anti HCV en 5/14 pacientes con DM/PM
confirmado por con RNA-HCV por PCR en 4 de ellos 15. Por el
contrario, MongerR y col hallaron una prevalencia de anti
HCV testeado por ELISA de 2da generación y confirmado por
RIBA de 1.9%, cifra similar a la población general de
1.4%16. También,Nishikai M y col detectaron anti HCV
positivo en 3/28 pacientes con (10.7%) y en 1/15 pacientes
con PM (6.7%), tampoco significativamente diferente a la
población control.17
Una sola paciente tenía autoanticuerpos compatibles con
autoinmunidad hepática, pero a pesar que hepatitis
autoinmune no pudo ser confirmada, en este estudio no
encontramos un aumento de la asociación entre MII y
hepatopatías autoinmune.
Recientes reportes, muestran que la TGP puede incrementar
después de la injuria tisular, en forma similar a la TGO, la
LDH y la CPK, lo cual indica que las células del músculo
esquelético tienen una reserva de
alaninoaminotransferasa.3 Un artículo de Nathwani, et al
describe 16 pacientes con injuria muscular, 4 pacientes por
ejercicio extremo, 6 por polimiositis y 6 por convulsiones
con niveles elevados de TGP en ausencia de otra evidencia de
enfermedad hepática.18 En otro estudio, en un análisis
retrospectivo de 61 pacientes con diagnóstico de miositis de
comienzo adulto (18 DM, 22, PM y 21 PM en ETC)se encontró
una fuerte correlación entre la CPK y la TGP (r=0.78,
p<0.0001.19
Existe una falta de reconocimiento de la correlación entre
la injuria del músculo esquelético y la elevación de la TGP.
Por esto, la elevación de TGP en los pacientes con miopatías
inflamatorias, a veces conduce a la búsqueda errónea de
hepatopatías concomitantes primarias o secundarias al
tratamiento recibido por los pacientes principalmente
antiinflamatorios no esteroideos (AINEs) y metotrexato (MTX).
En este estudio, durante la actividad de la miositis pudo
observarse elevación de transaminasas, inclusive de TGP.
Aproximadamente, la mitad de estos casos no pudieron ser
asociados a hepatopatía coexistente, lo cual podría a
atribuirse a la injuria muscular secundaria a la miopatía
inflamatoria. Tampoco encontramos asociación entre las MII y
portación crónica de hepatitis B y/o C. No pudimos
establecer si estos pacientes con TGP y/o TGO elevada
presentan algún rasgo clínico y/o serológico particular
Referencias
1. Maldonado JA, Citera G. Reumatología.- 1º edición.-
Martínez: Ediciones Azurras, 2010, pág 321.
2. Pratt DS, Kaplan MM. Primary Care: Evaluation of Abnormal
Liver-Enzyme Results in Asymptomatic Patients. N Engl J Med
2000;342(17):1266-71.
Full
Text
3. Shabaneh Al-Tamimi HA, McDonald R. Elevated Alanine
Aminotransferase Levels Associated With Polymiositis. Can
This Be Due to Muscle Injury? J Clin Rheumatol;14(6):363-4.
PubMed
4. McMurray RW and Elbourne K. Hepatitis C Virus Infection
and Autoimmunity. Semin Arthritis Rheum 1997;26:689-701.
PubMed
5. Masahiko N, Mamoru M and Satoshi K. Dermatomyositis
Following Infection with Hepatitis C Virus. J Rheumatol
1994;21:8.
6. Weidensaul D, Iman T, Holyst MM, et al. Polymiositis,
pulmonary fibrosis, and hepatitis C. Arthritis Rheum
1995;38:437-9.
PubMed
7. Alexander JA and Huebner CJ. Hepatitis C and Inclusion
Body Myositis. Am J Gastroenterol 1996;91(9):1845-6.
PubMed
8. Agha B, Rasheed M, Kenyon L and Jiménez S. Hepatitis C
Virus Infection, Inflammmatory Myopathy, and Pulmonary
Fibrosis: Are they Related? J Clin Rheumatol 2002;8(1):44-9.
PubMed
9. Bohan A, peter JB. Polymiositis and dermatomyositis. N
Engl J Med 1975;292:344-7.
10. LotharT. Clinical Laboratory Diagnostics: Use and
assessment of clinical laboratory results, English edition,
1998.
11. Angulo P. Nonalcoholic Fatty Liver. N Engl J Med
2002;346(16):1221-31.
12. Nojima T, Hirakata M, Sato S, Fujii T, Suwa A, Mimori T,
Ikeda Y. A case of polymyositis associated with hepatitis B
infection. Clin Exp Rheumatol 2000;18(1):86-8.
PubMed
13. Fernández-Fúnez A, Polo Romero FJ. Juvenile
dermatomyositis concomitant with hepatitis B vaccination.
Med Clin (Barc) 1998 v 21;111(17):675.
PubMed
14. Pizzigallo E, Cauda R, Pallavicini F, Picciotto A,
Servidei S, Tonali P, Ortona L. Viral hepatitis B and
polymyositis. Description of a case of polymyositis
associated with viral hepatitis B.
Pathologica1988;80(1065):73-9.
15. Ayabe M, Kawamoto M, Ijima H, Hino H, Shoji H. Clinical
characteristics and muscle histopathology in polymyositis
positive anti-hepatitis with C virus
antibody.RinshoShinkeigaku 1997;37(3):208-11.
16. Monger RM, West SG. Inflammatory myopathy and hepatitis
C virus infection. Arthritis & Rheum 1998;41(7):1323-5.
PubMed
17. Nishikai M, Miyairi M, Kosaka S. Dermatomyiositis
Following infection with hepatitis C Virus. J Rheumatol
1994;21(8):1584-5
18. Nathwani RA, Pais S, Reynolds TB and Kaplowitz N. Serum
Alanine Amintransferase in Skeletal Muscle
Diseases.Hepatology 2005;41(2):380-2.
19. Edge K, Chinoy H, Cooper RG. Serum alanine
aminotransferase elevations correlate with serum creatine
phosphokinase levels in myositis. Rheumatology
2006;45:488-90.
Full text
|