TRABAJOS ORIGINALES
Caracterización tóxica del
veneno de bothrops (rhinocerophis) alternatus de diferentes
regiones de la provincia de Córdoba (Argentina).
Daniela M. Rocco1; Gustavo Reati2; Vanessa Costa de
Oliveira1,3; Laura C. Lanari3; Rodrigo D. Laskowicz3;
Adolfo R. de Roodt1, 3
Revista Facultad de Ciencias
Medicas 2013; 70(1):7-13
1 Laboratorio de
Toxinopatología, Centro de Patología Experimental y
Aplicada, Facultad de Medicina, Universidad de Buenos Aires.
Uriburu 950, 5º piso, Facultad de Medicina, Universidad de
Buenos Aires, Ciudad Autónoma de Buenos Aires, Argentina;
aderoodt@gmail.com.
2Centro de Zoología Aplicada, Facultad de Ciencias Exactas,
Físicas y Naturales, Universidad Nacional de Córdoba.
3 Área Investigación y Desarrollo, Instituto Nacional de
Producción de Biológicos, Administración Nacional de
Laboratorios e Institutos de Salud “Dr. Carlos G. Malbrán”.
Velez Sarsfield 463, Ciudad Autónoma de Buenos Aires,
Argentina;
Introducción
Los venenos de serpientes son las secreciones con mayor
concentración de enzimas y toxinas en la naturaleza1,2. Son
producidos por glándulas labiales modificadas y tienen
secreciones muy similares a las del sistema digestivo, en
especial a la pancreática3. Su función primaria es la
paralización de las presas que constituyen su dieta,
interviniendo también en el proceso digestivo. El veneno
inoculado actúa desde el interior de las presas en las
cuales ha sido inyectado comenzando la hidrólisis de
tejidos, hasta que los jugos digestivos puedan alcanzar la
totalidad de los tejidos adecuadamente, debido a que estos
animales no pueden masticar a sus presas4.
La composición de los venenos de serpientes varía entre las
diferentes Familias, Géneros y Especies, existiendo también
variaciones intraespecíficas. Además las variaciones, pueden
ser de orden geográfico, estacional, ontogénico o
individual, o debidas a otras causas difíciles de
individualizar o clasificar. La variabilidad de los venenos
es mayor cuanto más complejo son estos, es decir cuanto
mayor es la cantidad de componentes que poseen5. Esto
implica que en el caso de los venenos botrópicos pueda
esperarse una complejidad importante. En el veneno de
Bothrops alternatus, se han identificado más de 100
componentes diferentes6.
Dentro de las serpientes venenosas de alta importancia
médica en Argentina, las Bothrops(conocida en general como
“yarará”, con siete especies diferentes en el país) son las
responsables de aproximadamenteel 98% de los accidentes por
serpientes venenosas7.
En Argentina, Bothrops alternatus(DUMÉRIL, BIBRON & DUMÉRIL,
1854)(“yarará grande”, “crucera”, “víbora de la cruz”,
“urutú”) y Bothrops diporus (“yarará chica”, “yarará overa”,
“cabeza candado”, “yararaca pintada”) son las causantes de
la mayoría de los accidentes ofídicos en todas las
provincias7. Actualmente a estas dos serpientes se sugirió
clasificarlas como Rhinocerophis alternatus y Bothropoides
diporus8, si bien otros autores sugieren que se consideren
como sinonimia9.
En estudios previos observamos variaciones importantes en
los efectos tóxicos del veneno de ejemplares de Bothrops
alternatus de diferentes regiones10-13, mientras que
no encontramos tanta variación entre los venenos de
ejemplares de Bothrops diporus14,15. También observamos que
la neutralización por antivenenos de uso terapéutico sobre
venenos de Bothrops alternatus de distintas regiones del
país, si bien efectiva, no es del mismo grado para todos los
venenos de esta especie16.
Bothrops alternatus es una de las serpientes venenosas de
mayor aparición en la provincia de Córdoba junto con
Bothrops diporus17-19. Se encuentran distribuidas en
todo el territorio de la provincia, aunque en zonas
geográficamente diferentes18. Esta especie en Córdoba
prefiere ambientes amplios de pastizales, húmedos o
asociados a cursos de agua, aunque también habita en valles
serranos protegidos y con mayor grado de humedad. Desde un
punto de vista biogeográfico llama la atención su presencia
en el valle de Traslasierras, en el este de la provincia,
una zona aislada geográficamente en el oeste del resto del
territorio por las cadenas montañosas.
Debido a las diferencias en toxicidad y neutralización de
actividades tóxicas del veneno de Bothrops alternatus de
ejemplares de diferentes regiones y aún de una misma
provincia, como en los casos de la provincia de Buenos Aires
o Entre Ríos10,11,13,16, se decidió estudiar la toxicidad
del veneneno de ejemplares de diferentes regiones de la
provincia de Córdoba. Las serpientes cordobesas de este
género, debido al aislamiento geográfico en estas
poblaciones, podrían presentar caracterísitcas
diferenciales. En este trabajo se estudiaron algunas
características tóxicas de venenos de Bothrops
alternatusprovenientes de tres diferentes regiones de la
provincia de Córdoba y la neutralización de estas
actividades tóxicas por el antiveneno terapéutico
mayoritariamente utilizado en esa provincia.
Materiales y Métodos
Área de estudio: los venenos provienen de serpientes
capturadas en la Provincia de Córdoba (Figura 1). Córdoba
incluye un área central montañosa (altura máx 2790 m/snm[sobre
el nivel del mar]) rodeada por una vasta planicie levemente
ondulada de 600 - 900 m de altura. Las temperaturas siguen
un gradiente norte-sur, con una media anual entre 18-10°C,
una máxima media entre 27º y 14º C, y una mínima media entre
11º y 5º C. Las precipitaciones decrecen de este a oeste,
con una media anual de 900 mm en el este a menos de 400 mm
en el oeste; las lluvias están concentradas en el verano
(octubre-marzo)20.
La región en estudio comprende tres eco regiones diferentes:
a) Chaco Serrano (en las montañas centrales) con vegetación
seca de bosques y arbustales entre 300 – 1350 m/snm, y
pastizales de altura (sobre los 1350 m/snm); b) bosques y
arbustales chaqueños secos (norte, centro y oeste de la
provincia), y c) pastizales pampeanos, (este y sur)
actualmente usados para agricultura y ganadería (Figura
1)21.
Venenos: se utilizó veneno de ejemplares adultos de
Bothrops alternatus provenientes de tres diferentes regiones
de la provincia: del Valle de Calamuchita (Villa General
Belgrano y El Durazno), grupo del valle de Traslasierras
(Villa Dolores, Nono, La Travesía y Las Rabonas) y grupo del
Este de Córdoba (Balnearia, Noethinger, Villa María,
Trinchera y Las Varillas), alojados en el Serpentario del
Centro de Zoología Aplicada de la Universidad Nacional de
Córdoba (Figura 1). El veneno en todos los casos fue
obtenido por extracción manual mediante estimulación
eléctrica, desecado al vacío y guardado a -20ºC hasta su
uso. Se utilizaron venenos provenientes de dos extracciones
realizadas con una diferencia de un mes entre una y otra.
Para todos los estudios el veneno fue resuspendido y diluido
en NaCl 0.15 M.
Animales de experimentación: se trabajó con ratones
de la cepa CF-1 (18-22 g) y ratas Wistar (250 g)
provenientes del bioterio del Instituto Nacional de
Producción de Biológicos de la Administración Nacional de
Laboratorios e Insitutos de Salud “Dr. Carlos G. Malbrán”,
del Ministerio de Salud de la Nación (INPB). Los animales
fueron alimentados con alimento para roedores y agua ad
libitum, con períodos de luz / obscuridad de 12 horas. Pare
el trabajo con animales se siguieron los lineamientos
sugeridos por el National Institute of Health22.
SDS-PAGE: se realizó la electroforesis en gel de
poliacrilamida con presencia de dodecilsulfato de sodio (acrilamida
/ bisacrilamida al 12.5%) según métodos convencionales23,
sembrando 10 µg de veneno de las diferentes zonas. Las
muestras de veneno se corrieron juntamente con marcadores de
masa molecular de amplio rango (Promega, wide range) en una
cuba Mini Protean II (Bio Rad). Una vez corridos, los geles
se fijaron y tiñeron con azul brillante de Coomasie.
Antiveneno: se utilizó antiveneno antibotrópico
Bivalente (Lote 259; X/2006), del INPB. Este antiveneno se
produce inmunizando equinos con venenos de Bohrops
alternatus y Bothrops diporus y su presentación framacéutica
es a fragmentos F(ab´)2 de inmunoglobulinas equinas, en forma
líquida7.
Determinación de la potencia letal: se utilizaron
grupos de 6-8 ratones de la cepa CF-1, de 18 - 22 g de peso
por nivel de dosis, que se inocularon con diferentes dosis
de veneno diluidos en un volumen final de 0.5 ml de NaCl
0.15 M por la vía intraperitoneal (i.p.). A las 48 horas
posteriores a la inoculación, se determinó el porcentaje de
sobrevivientes en cada nivel de dosis y la Dosis Letal Media
(DL50) se estimó a partir de la curva dosis-respuesta
mediante análisis de regresión no lineal24.
Determinación actividad Hemorrágica: se determinó de
acuerdo a la técnica descripta por Theakston y Reid25.
Brevemente, ratas Wistar de 250 g de peso, previamente
sedadas con acetilpromacina-ketamina por la vía
intramuscular, fueron inyectadas por la vía intradérmica (i.d.)
con 100 µl de solución de NaCl 0.15 M conteniendo 1.0 -
300.0 µg de veneno. El veneno fue disuelto en NaCl 0.15 M e
inyectado en un volumen de 100 µl. A las 24 horas los
animales fueron sacrificados por sobredosis anestésica y se
midieron los diámetros mayores perpendiculares de las áreas
hemorrágicas en la cara dérmica con un calibre. Se definió
la Dosis Mínima Hemorrágica (DMH) como la cantidad de veneno
que resulta en un área hemorrágica con un diámetro mayor
promedio de 1.0 cm.
Determinación de la actividad procoagulante en plasma
humano: se determinó tratando 0.4 ml de plasma humano normal
conteniendo 2.8 g/L de fibrinógeno con diferentes
concentraciones de veneno en 50 µl de NaCl 0.15 M. Una dosis
procoagulante mínima en plasma humano (DMC-P) se definió
como la dosis de veneno que produce la formación de un
coágulo evidente en 60 segundos25.
Determinación de la actividad procoagulante en fibrinógeno:
se determinó de acuerdo a Theakston y Reid,(25), con algunas
modificaciones, tratando 0.2 ml de una solución de 2.0 g% de
fibrinógeno bovino (Sigma) en NaCl 0.15 M, con diferentes
concentraciones de veneno en 50 µl de NaCl 0.15 M. Una dosis
procoagulante mínima en fibrinógeno (DMC-F) se definió como
la dosis de veneno que produce la formación de un coágulo
evidente en 60 segundos.
Seroneutralizaciónde la letalidad: se realizó
mediante la técnica recomendada internacionalmente para
evaluar antivenenos26, desafiando animales con una dosis
constante de veneno pre-incubada con diferentes dosis de
antiveneno. Para cada dosis se utilizaron grupos de 5
ratones CF-1, de 18-22 g de peso. Los ratones se inyectaron
por vía i.p. con 5 DL50 de venenopre-incubado 30 min a 37ºC
en un volumen final de 0.5 ml/ratónen NaCl 0.15 M (control
positivo) o con distintas cantidades de los diferentes
antivenenos con el mismo volumen final. El grado de
protección se estimó como DE50 (Dosis Efectiva 50%), que
expresa la cantidad de antiveneno que reduce la mortalidad
en un 50%, considerando los animales sobrevivientes a las 48
hs. La DE50 se estimó mediante el estudio por regresión no
lineal, considerando la protección en función de la dosis de
antiveneno. Además, se calculó la potencia neutralizante
como la cantidad de mg de veneno neutralizados por 1 ml de
antiveneno27.
Seroneutralización de la actividad hemorrágica: se
realizó de la siguiente manera. Grupos de tres ratas Wistar
de 250 g se inyectaron por vía i.d. con 2 DMH de cada veneno
pre-incubado 30 min a 37ºC con NaCl 0.15 M (control
positivo) o con distintas cantidades del antiveneno
Bivalente. El área de hemorragia se calculó de la forma
mencionada y se le asignó un valor de 100 % a la media del
área hemorrágica determinada en el grupo control positivo.
Se determinaron las DE50 (dosis de veneno que reduce a la
mitad el área hemorrágica respecto a los controles
positivos) de cada antiveneno, mediante el estudio por
regresión no lineal de la curva de área hemorrágica en
función de las dosis de antiveneno.
Seroneutralización de la actividad procoagulante en
plasma: se determinó utilizando la técnica descripta por
Theakston & Reid25. Se pre-incubaron 6 DMC-P de los
diferentes venenos con distintas dosis de antiveneno durante
30 minutos a 37ºC, en un volumen final de 150 µl con NaCl
0.15 M. Tras la incubación, se adicionaron las mezclas a 500
µl de plasma humano normal (contenido de fibrinógeno 2.8
g/L) y se determinaron los tiempos de coagulación. Los
controles positivos fueron 6 DMC-P de veneno diluido en NaCl
0.15M en un volumen final de 150 µl. La inhibición de la
actividad procoagulante se estimó como la dosis mínima de
antiveneno que inhibió la coagulación del plasma durante
diez minutos, tras la coagulación de los controles
positivos.
Estadísticos: para determinar la significación
estadística de los resultados, cuando fue necesario, se
utilizó el estadístico t de Student. Los análisis
estadísticos (regresión lineal, regresión no lineal y otros)
se realizaron por medio del software Prism 4.0 (GraphPad
Inc. San Diego, California, USA). Los resultados fueron
expresados como media
±
desvío estándar (DS). Los intervalos
de confianza del 95% (IC 95%) se expresaron entre
paréntesis.
Resultados
El patrón electroforético de las tres muestras fue muy
similar, observándose la mayoría del material entre los
30-40 kDa y alrededor de los 20 kDa (Figura 2). Esto es
coincidente con los patrones electroforéticos observados en
venenos de ejemplares individuales de esta especie28 y en el
veneno de serpientes de esta especie de diferentes regiones
de la Argentina13.
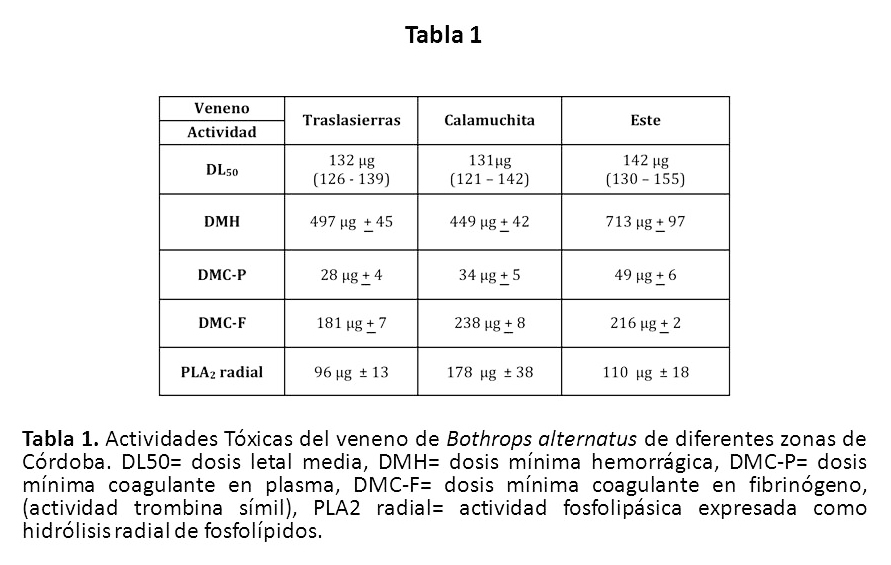
La potencia letal fue muy similar en todas las muestras,
encontrándose entre los 130–140 µg / ratón. No se
encontraron diferencias significativas entre las muestras (p
< 0.05). De acuerdo a lo esperado, todos los venenos
presentaron actividades hemorrágica, coagulante y
fosfolipásica.
La actividad hemorrágica de todas las muestras fue muy poco
potente. Las de los venenos de serpientes de Calamuchita y
Traslasierras fue muy similar (p 0.7357; t= 0.3429) siendo
el veneno menos hemorrágico el proveniente del Este (p
0.0002; t= 5.811).Todas las muestras mostraron actividad
coagulante sobre el plasma y el fibrinógeno. Si bien no
hubieron diferencias significativas la DMC-P entre las
muestras de Calamuchita y Este (p> 0.05; t < 0.7 en ambas
comparaciones), la muestra de Traslasierras (DMC-P= 28 µg/ml)
mostró mayor potencia que la del Este (DMC-P= 49 µg/ml; p
0.0433; t= 2.918). La actividad trombina símil fue diferente
en todas las muestras (p< 0.05; t> 4.0 en todos los casos).
El veneno de Traslasierras fue el que presentó la mayor
actividad, seguido por el del Este, siendo el de Calamuchita
el que presentó la menor actividad. La actividad
fosfolipásica fue similar entre las muestras del Este y
Traslasierras (p 0.3341; t= 1.097) siendo la de Calamuchita
la que presentó la menor actividad (p< 0.05; t> 2.7). Todos
los resultados se muestran en la Tabla 1 y Figura 2. El
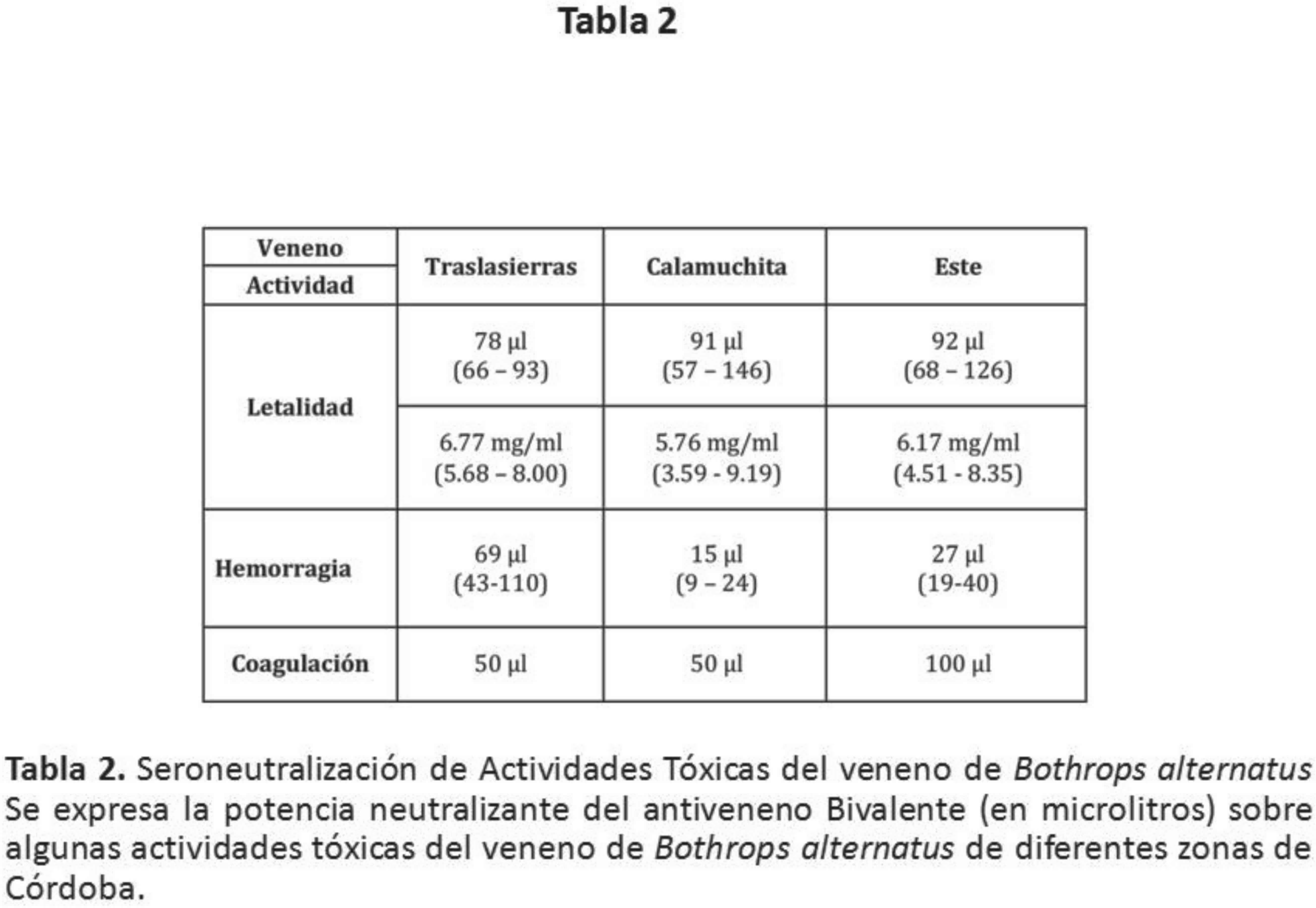
antiveneno Bivalente utilizado, neutralizó eficientemente
las actividades tóxicas probadas. Ver Tabla 2.La potencia
letal y la actividad procoagulante en plasma fueron
neutralizadas eficientemente en todos los casos. La potencia
neutralizante de la letalidad conferida por el antiveneno se
encontró entre los 5 – 7 mg de veneno por ml de antiveneno.
Nose observarondiferencias significativas estadísticamente
(p< 0.05) respecto a la neutralización de la potencia letal
de los venenos. La neutralización de la actividad coagulante
fue muy similar en todos los casos, inhibiendo la
coagulación causada por el veneno en dosis de 50 – 100 µl de
antiveneno.
Respecto a la neutralización de la actividad hemorrágica, se
vieron diferencias en la capacidad neutralizante del
antiveneno sobre las diferentes muestras. Siendo mejor
neutralizado el veneno de Calamuchita, seguido por el del
Este mientras que el de Traslasierras fue el que requirió
mayor dosis para ser neutralizado (p< 0.05).
Imágenes
 |
 |
| |
|
Discusión
Bothrops alternatus es una de las serpientes que con mayor
frecuencia es hallada en la provincia de Córdoba17,18. En
esta provincia, al igual que en Argentina7 y toda
Sudamérica, la mayoría de las mordeduras por serpientes son
producidas por las diferentes especies de Bothrops
(actualmente en Argentina divididas en tres géneros: Bothops,
Rhinocerophis y Bothropoides). Si bien las especies de
Bothrops responsables de los accidentes no están claramente
identificadas en los informes epidemiológicos, considerando
los hallazgos de las especies de Bothrops en esta provincia,
posiblemente los accidentes se deban mayoritariamente a B.
diporus y a B. alternatus19, en coincidencia con lo que
sucedería a nivel nacional7. Bothorps alternatus, debido a
su tamaño y a la cantidad de veneno que produce, que puede
superar los 300 mg en peso seco29, puede provocar
accidentes de mucha gravedad.
La variación en toxicidad de venenos de una misma especie,
además de las variaciones individuales intraespecíficas,
pueden deberse a la localización geográfica. Esta puede
relacionarse con diferentes dietas30-32 y estados
metabólicos por las condiciones geográficas y climáticas,
que podrían afectar la producción de veneno5. También, éstas
podrían deberse a la carga genética de las serpientes en las
diferentes regiones, debido a aislamiento geográfico o
adaptación a distintas condiciones ambientales5,30,31,32. En
este estudio, no encontramos grandes diferencias
cualitativas o cuantitativas entre las muestras de veneno, a
pesar de provenir de diferentes localidades de la misma
provincia, como aquellas halladas en el veneno de Bothrops
alternatus provenientes de distintas zonas de las provincia
de Buenos Aires10,13 o de la provincia de Entre Ríos11,13,16,33
El patrón electroforético de las muestras fue muy similar
(Figura 2), en coincidencia con los patrones
electroforéticos observados en venenos de esta especie28,13.
Solamente se pudo ver que una banda débilmente teñida en el
orden de los 25 kDa observable en los venenos de
Traslasierra y Calamuchita, está ausente en la muestra
proveniente de venenos de serpientes del Este de la
provincia.
Respecto a las actividades tóxicas del veneno de las
regiones, están dentro de los rangos descriptos para las
mismas en Argentina10-13, 16, 28, 29, 34,35. Sin embargo,
algunas actividades como la potencia letal (en los tres
casos superior a los 130 µg / ratón), fue menor a la
observada en venenos de serpientes de otras provincias13. En
otras muestras de venenos de Argentina, se encontraron en
general dosis letales (determinadas por la vía i.p.) en un
rango en general entre los 30 y 120 µg/ratón13, 28, 29, que
muestran mayor potencia que los determinados en estas
muestras. Sin embargo, los valores obtenidos en este trabajo
son coincidentes con datos previos sobre la potencia letal
del veneno de B. alternatus de serpientes cordobesas de
diferentes localidades, que mostró una potencia letal de
134.9 µg / ratón13.
Las potencias hemorrágica y coagulante en plasma o
fibrinógeno fueron muy bajas en comparación a las observadas
en muestras provenientes de otras provincias e incluso de
muestras de veneno de serpientes de diferentes zonas de
Córdoba12, 13. Una explicación posible a este fenómeno,
podría ser que los pooles de veneno constituidos por
diferentes muestras, poseerían distintas formas y/o
isoformas de los componentes tóxicos, como los hemorrágicos
o coagulantes. La presencia de diferentes formas o isoformas
con distintas actividades o diferentes especificidades por
los distintos sustratos de la matriz extracelular podría
aumentar la actividad hemorrágica del pool en referencia a
las muestras individuales que constituyeron el pool. Esto lo
hemos observado ocasionalmente con algunas muestras de
veneno de B. alternatus13 y podría parcialmente explicar
estas diferencias.
El antiveneno Bivalente es el de mayor uso en la Argentina.
Se distribuye a todas las provincias a través del Ministerio
de Salud de la Nación7, a excepción de la provincia de
Buenos Aires. Esta última, utiliza los antivenenos
producidos por el Laboratorio Central de Salud Pública de
esa provincia, los cuales son distribuidos por el Ministerio
de Salud provincial. El antiveneno botrópico producido por
ese Laboratorio es desarrollado mediante la inmunización de
equinos con los mismos inmunógenos que los utilizados para
el Bivalente, es decir los venenos de B. alternatus y B.
diporus según la clasificación más reciente.
El antiveneno Bivalente neutralizó, en todos los casos, las
actividades tóxicas ensayadas en rangos de potencias muy
similares. Respecto a la potencia letal, 1 ml del antiveneno
neutralizó entre 5–7 mg de veneno, lo que está por sobre los
requerimientos en la Argentina, que son de 2.5 mg/ml36, si
bien esta considera la vía intravenosa y no la
intraperitoneal como la usada en este ensayo. La capacidad
neutralizante estuvo aún por sobre los requerimientos en
Brasil, que exigen una protección de 5 mg/ml para el
antiveneno botrópico y utilizando en este caso la vía i.p.
para los desafíos27. Por este motivo se puede suponer que
este antiveneno, aunque no se produce regularmente o
mayoritariamente con el veneno de serpientes cordobesas, es
capaz de neutralizar eficientemente al mismo.
Siguiendo las recomendaciones internacionales26, 34, 25, 38, no
solo evaluamos la capacidad neutralizante sobre la letalidad
(que es multifactorial) sino sobre actividades tóxicas
particulares como la hemorragia y la actividad coagulante en
plasma. En todos los casos el antiveneno fue capaz de
neutralizar dichas actividades, mostrando ser eficiente para
bloquear la acción de los componentes hemorrágicos (metaloproteinasas,
llamadas hemorraginas)39 y de las enzimas procoagulantes
(principalmente proteasas de serina), las mayores
responsables de las hemorragias incoercibles que se observan
en estos envenenamientos40.
La actividad hemorrágica del veneno de las serpientes de
Traslasierras requirió algo más de antiveneno para ser
neutralizada, respecto a la requerida para neutralizar el
veneno de las serpientes de las otras zonas (p< 0.05). Esto
tal vez podría ser debido a alguna variación cuali o
cuantitativa en la cantidad de metaloproteinasas o proteasas
de serina en el veneno de estas serpientes respecto a las de
las otras zonas, si bien serían necesarios otros ensayos
para poder afirmarlo.
El veneno de las serpientes cordobesas estudiadas, presenta
las actividades características de los venenos de la mayoría
de las Bothrops, causando hemorragias y alteraciones en el
sistema hemostático, afectando tanto al plasma como actuando
directamente sobre el fibrinógeno mediante una actividad
trombina símil. Esta última actividad se observa en la
mayoría de las especies de Bothrops pero no en todas28, 41 y
puede incluso ser extremadamente baja o estar ausente aún en
el veneno de serpientes de una misma especie13.
Los pooles de venenos de serpientes de las diferentes
regiones de Córdoba fueron muy similares en cuanto a sus
características tóxicas a diferencia de lo observado con B.
alternatus de Entre Ríos o de la Provincia de Buenos
Aires11 ,33, 13, 16. Sus actividades presentaron una potencia
muy parecida, siendo en algunos casos algo menor que las
potencias tóxicas que observamos en el veneno de Bothrops
alternatus de otras regiones. El antiveneno utilizado por el
Ministerio de Salud de Córdoba para tratar los accidentes
por Bothrops neutralizó eficientemente los venenos
estudiados. Trabajos sobre la variación bioquímica y
toxicológica individual de ejemplares de estas tres
distintas regiones podrían proveer una más profunda
información sobre la variación toxicológica de los venenos
de las serpientes de esa provincia, como se ha observado en
venenos de serpientes de poblaciones provenientes de una
misma localidad13, 16.
Referencias
1.Vidal J.C. Venenos de serpientes. Bioquímica y
Farmacología. Ciencia e Investigación 1976, 32: 3-23.
2.Vidal, J.C. Bioquímica de los venenos ofídicos. Boletín de
la Asociación Herpetológica Argentina, 1988, 4(1): 6-10.
3. Kochva, E. The origin of snakes and evolution of the
venom apparatus.Toxicon1987, 25(1): 65-106.
PubMed
4.de Roodt A.R. Ofidios Venenosos y sus Venenos. En:
Sistemática y Filogenia de los Vertebrados, con énfasis en
la fauna argentina. Ricardo Montero y Analía Autino Eds.
2009, pp. 233-242. ISBN 978-987-05-6743-1. Tucumán,
Argentina.
5. ChippauxJ-P., Williams V., White J. Snake venom
variability: methods of study, results and interpretation.
Toxicon1991, 29, 1279-1303.
PubMed
6.Öhler M., Georgieva D., Seifert J., von Bergen M., Arni
R.K., Genov N., Betzel Ch. The Venomics of
Bothropsalternatus is a Pool of Acidic Proteins with
Predominant Hemorrhagic and Coagulopathic Activities.
Journal Proteomic Research 2010, 9: 2422–2437.
PubMed
7. Ministerio de Salud. Guía de prevención, diagnóstico,
tratamiento y vigilancia epidemiológica de los
envenenamientos ofídicos.Ministerio de Salud, 2007.
Full Text
8. Fenwick A.M., Gutberlet R.L., Evans J.A., Parkinson C.L.
Morphological and molecular evidence for phylogeny and
classification of South American pitvipers, genera Bothrops,
Bothriopsis, and Bothrocophias (Serpentes: Viperidae).Zoological
Journal of the Linnean Society2009, 156: 617–640.
9. Carrasco P.A., Mattoni C.I., Leynaud G.C., Scrocchi G.J.
Morphology, phylogeny and taxonomy of South American
bothropoidpitvipers (Serpentes, Viperidae). ZoologicaScripta.
The Norwegian Academy of Science and Letters, 2012, 1-16.
Abstract
10.Lanari L., González M., Liria N., Laskowicz R.,
Manzanelli V., Herman D., Dolab J., de Roodt A..
Caracterización Tóxica del Veneno de Bothrops alternatus de
Diferentes Zonas de Buenos Aires.Acta Toxicológica Argentina
2006a,14(2): 51.
11. Lanari L., Laskowicz R., Liria N., González M.,
Manzanelli V., Herman D., Dolab J., Reati G., de Roodt A.
2006b.Caracterización Tóxica del veneno de Bothrops
alternatus provenientes de diferentes regiones de la
Argentina. VII Congreso Argentino de Herpetología .
Corrientes 29/11 al 01/12 de 2006b. Asociación Herpetológica
Argentina.
12. Lanari L.C., Gonzalez M.E., Liria N.C., Laskowicz R.D.,
Manzanelli P.P. Galarce, J.A. Dolab, D.I.J. Herman, de Roodt
A.R. Toxic characteristics of the venom of
Bothropsalternatus from Argentina.IX Congreso Panamericano
de la Sociedad Internacional de Toxinología. Juriquilla,
Querétaro, México. 21 al 25 de Octubre de 2007.
13. Lanari L.C., Rosset S., González M.E., Liria N., de
Roodt A.R. 2010. A study on the venom of
BothropsalternatusDuméril, Bibron and Duméril, from
different regions of Argentina. Toxicon2010, 55(8):
1415-1424.
PubMed
14. Oliveira, V.C.; Lanari, L.C; Baudou, F.G; Manzanelli,
V.M; Laskowicz, R.D.; de Roodt, A. Variaciones del veneno de
Bothropsdiporus de diferentesregiones de Argentina. R.XII
Congreso Argentino de Herpetología, desarrollado en San
Salvador de Jujuy en el mes de octubre de 2009. Libro de
Resúmenes.
15. Oliveira, V.C.; Lanari, L.C, Hajos, S.E, de Roodt, A.R.,
Toxicity of Bothrops neuwiedi complex (“yarará chica”) venom
from different regions of Argentina (Serpentes,
Viperidae)Toxicon 2011, 57:680–685
PubMed
16. de Roodt A.R., Lanari L.C., Costa de Oliveira V.,
Laskowicz R.D., Stock R.P. Neutralization of
Bothropsalternatus regional venom pools and individual
venoms by antivenom: a systematic comparison. Toxicon2011,
57: 1073 – 1080.
PubMed
17.Reati, G.J.Serpientes de la Provincia de Córdoba,
Argentina. En: Biodi-versidad de la Provincia de Córdoba:
Fauna. 1996, Vol. I (I.E. di Tada y E.H. Bucher, eds.). pp.
239-254. Universidad Nac. De Río Cuarto.
18.Leynaud G.C., Reati G.J., Bucher E.H. Annual activity
patterns of snakes from Central Argentina (Córdoba province).
Studies on Neotropical Fauna and Environment2008, 43(1):
19-24.
Abstract
19.Leynaud G.C. &Reati G.J. Identificación de las zonas de
riesgo ofídico en Córdoba, Argentina, mediante el programa
SIGEpi. Rev Panam Salud Publica 2009, 26(1): 64-69.
Scielo
20.Capitanelli R.G. Clima. En: Geografía Física de la
Provincia de Córdoba, 1979, p. 45-138. Vázquez J. Miatello
R., Roqué M., Eds, Boldt, Buenos Aires, Argentina.
21.Luti, R., Bertran, M., Galera, M., Muller, N., Nores, M.,
Herrera, M., Barrera, J.C.Vegetación. En: Geografía Física
de la Provincia de Córdoba, 1979,p. 297–368. Vázquez, J.
Miatello, R., Roqué, M., Eds, Boldt, Buenos Aires,
Argentina.
22.National Research Council. Guía para el cuidado y uso de
los animales de laboratorio. 2002. Institute of Laboratory
Animal Resources, Commission of Life Sciences. Academia
Nacional de Medicina, Eds. México DF.
23.Laemmli U.K. Cleavage of structural proteins during the
assembly of the head of bacteriophage T4. Nature1970, 227:
680-685.
Abstract
24.Casasola A., Ramos-Cerrillo B., de Roodt A.R., Carbajal
A., Alagón A., Stock R.P. Paraspecific neutralization of the
venom of African species of cobra by an equine antiserum
against Najamelanoleuca: a comparative study. Toxicon2009,
53: 602-608.
PubMed
25.Theakston, R.D.G., Reid, H.A., 1983. Development of
simple standard assayprocedures for the characterization of
snake venoms. Bulletin of the World Health Organization 61,
949-956.
Full Text
26.World Health Organization. Progress in the
Characterization of Venoms and Standarization of Antivenoms.
Offset , WHO, Geneva, 1981.
27.Ministerio de Saúde..NormasTécnicas de Fabricacao e
Controle de Qualidade dos Soros Antiofídicos, Antitóxicos en
Antirrábico aprovada pela vigilancia sanitaria. Secretaría de
Vigilancia Sanitaria, 1996, Ministerio de Saúde.
28.de Roodt A.R. . Estudio Inmunobiológico del Veneno de
Serpientes de Importancia Sanitaria de la Argentina.2002,
Tesis Doctoral. Facultad de Farmacia y Bioquímica de la
Universidad de Buenos Aires.
29.de Roodt, A. R., Dolab, J. A., Galarce, P. P., Litwin,
S., Gould, E., Dokmetjian, J. C., Segre, L. and Vidal, J. C.
A Study on the Venom Yield of Venomous Snake Species from
Argentina. Toxicon1998,36, 1949-1958.
PubMed
30.Daltry, J.C., Wuster, W., Thorpe, R.S.. Diet and snake
venom evolution. Nature1996, 379, 537–540.
PubMed
31.Sasa M. Diet and snake venom evolution: Can
localselection alone explain intraspecific venomvariation?
Toxicon1999, 37: 249 – 252.
PubMed
32.Gibbs H.L., Rossiter W. Rapid Evolution by Positive
Selection and Gene Gain and Loss: PLA2 Venom Genes in
Closely Related Sistrurus Rattlesnakes with Divergent Diets.
J Mol Evol:2008, 66:151–166.
Abstract
33.de Roodt A.R., Lanari L.C., Laskowicz R.D., Botassi .S,
Rocco D.M., Costa de Oliveira V., Regner P.I.. Comparación
de caracteres corporales y del veneno de Rhinocerophis
alternatus entre poblaciones de las provincias de Buenos
Aires y Entre Ríos, Argentina. Cuadernos de
Herpetología 2012, 26(1). En prensa.
Full Text
34. Sanchez, E.F., Freitas, T.B., Ferreira-Alves, D.L.,
Velarde, D.T., Diniz, M.R., Cordeiro, M.N., Agostini-Cotta,
G, Diniz, CR. Biological activities of venoms from South
American snakes. Toxicon1992, 30(1): 95-103.
PubMed
35.de Roodt A.R., Litwin S., Vidal J.C. Hemorrhagic activity
of Bothrops venoms determined by two different methods and
relationship with proteolytic activity on gelatin and
lethality.Toxicon2003, 41(8): 949-958, 2003.
PubMed
36. Farmacopea Nacional Argentina. 1978. Pág. 857. Ed. Codex,
Bs.As. 1283 pp.
37.World Health Organization. WHO Guidelines for the
Production Control and Regulation of Snake Antivenom
Immunoglobulins. 2010, 110.http://www.who.int/bloodproducts/snake_antivenoms/SnakeAntivenomGuideline.pdf .
38.Theakston RD, Warrell DA, Griffiths E.Report of a WHO
workshop on the standardization and control of antivenoms
Toxicon. 2003, 41(5):541-57
PubMed
39.Bjarnasson J.B. & Fox J.W. Hemorrhagic metalloproteinases
from snake venoms. Pharmac. Ther. 1994, 62: 325-372.
PubMed
40.Markland F.S. Snake venoms and the hemostatic system.
Toxicon1998, 36(12): 1749-1800.
PubMed
41.de Roodt A.R., Lanari L.C., Clement H., Manzanelli V.M.,
Alagon A. Some toxic and biochemical characteristics
activities of Bothropsammodytoides venom. IX Congreso
Panamericano de la Sociedad Internacional de Toxinología.
Juriquilla, Querétaro, México. 21 al 25 de Octubre de 2007.
Libro de Resúmenes.
|