ARTÍCULOS ORIGINALES
Asociación entre lesiones placentarias y
lesiones isquémico hemorrágicas cerebrales precoces
detectadas por ecografía en prematuros menores de 1500
gramos y 32 semanas
The relationship between placental lesions and early
hemorrhagic-ischemic cerebral injury in very low birth
weight infants
Dra Mara Vaihingera, Dra Nancy Mazzitellib, Dra Nora
Balaniana, Dr Carlos Grandic
Revista Facultad de Ciencias Medicas 2013; 70(3):123-133
a. División Neonatología,
b. Unidad Anatomía Patológica,
c. Epidemiología Perinatal y
Bioestadística, Hospital Materno-Infantil Ramón Sardá,
Buenos Aires, Argentina
Maternidad “Ramón Sarda”:
Esteba de Luca 2151, Buenos Aires, Argentina
Correspondencia:
cgrandi@intramed.net
Participación de los autores: Todos contribuyeron al
desarrollo e implementación del estudio, análisis de
resultados, redacción del artículo y aprobación de su
versión final.
Fuente de financiamiento: El presente trabajo de
investigación fue realizado con el apoyo de una Beca “Ramón
Carrillo-Arturo Oñativia”, categoría iniciación, otorgada
por el Ministerio de Salud de la Nación, a través de la
Comisión Nacional Salud Investiga.
Conflictos de interés: ninguno que declarar
Introducción
El parto prematuro se asocia a discapacidad y resultados
neurológicos adversos, siendo la hemorragia intraventricular
(HIV) y las lesiones de la sustancia blanca cerebral (LSBC)
las principales etiologías propuestas.1 Los recién nacidos
prematuros (RNPT)
£
a 32 semanas y ≤1500 g representan en
Argentina el 1.2% del total de recién nacidos (RN) vivos y
contribuyen al 33% de la mortalidad infantil con una
sobrevida del 60%.2 En América Latina las lesiones isquémico
hemorrágicas cerebrales (LIHC) se observan en el 10% de los
RNPT y su frecuencia es mayor a menor edad gestacional (EG).3
Los posibles mecanismos responsables de las LIHC son
complejos e involucran factores vinculados con el flujo
sanguíneo cerebral, la vulnerabilidad intrínseca del
oligodendrocito en fase de diferenciación, citoquinas y
radicales libres.4-8
La ecografía cerebral es útil para detectar HIV, lesiones
quísticas y ventriculomegalia (VMG).9
La histopatología placentaria permite evaluar lesiones que
podrían intervenir en la injuria cerebral directa o
indirectamente por el aumento de su asociación con
complicaciones neonatales.10,11
La inflamación intrauterina activa las células de la
placenta y la decidua para producir numerosas citoquinas
proinflamatorias en la interface materno-fetal, incluyendo
el factor de necrosis tumoral – alfa, interleuquina-1b,
interferon-g, interleukina-6 e interleukina-8. El incremento
de las citoquinas pro-inflamatorias se asocian con aumento
en la incidencia de displasia broncopulmonar y lesiones
cerebrales, en especial la HIV y la leucomalacia
periventricular, fuertes predictores de compromiso del
neurodesarrolo.12
Existen controversias sobre la asociación entre
corioamnionitis histológica (CH) y LIHC. Así, mientras
algunos estudios muestran asociación entre CH y LSBC13,14
o HIV,10,11,15 otros no evidencian ninguna asociación
entre CH y HIV temprana16 o LSBC en su forma quística17 y
no quística.18
El objetivo del presente estudio fue comparar las lesiones
placentarias de hipoperfusión vascular materna y fetal y
lesiones inflamatorias agudas y crónicas en RNPT portadores
de LIHC detectadas por ecografía cerebral antes de las 72
horas de vida, con las halladas en RNPT sin LIHC.
Material y métodos
El estudio se desarrolló en la Unidad de Cuidados Intensivos
y de Anatomía Patológica del Hospital Materno Infantil Ramón
Sardá de la Ciudad Autónoma de Buenos Aires. Se trata de un
Hospital público de nivel terciario.
El diseño del estudio fue retrospectivo, tipo caso –
control. La población fueron los RN vivos
³
a 500 g y 24
semanas y
£
a 1500 g y 32 semanas entre el 01-01-2006 y el
01-03-2012. Se excluyeron los RNPT gemelares, con
malformaciones congénitas, infecciones intrauterinas
específicas, los fallecidos en sala de partos o antes de las
24 horas de vida y la falta de información histopatológica
de la placenta y ecografía precoz.
La variable dependiente (resultado) fue la ecografía
cerebral dentro de las 72 horas de vida normal o con una o
más de las siguientes lesiones: leucomalacia periventricular
(LPV) según la clasificación de D’Vries19 , infarto
hemorrágico periventricular (IHP),20 VMG9,HIV según la
clasificación de Papile21 e hidrocefalia post hemorrágica21
. La variable independiente fue la lesión placentaria que
se clasificó en 4 grupos22 1.- Lesiones del compartimiento
vascular materno (LCVM, aumento de nudos sinciciales,
vasculopatía decidual, múltiples infartos); 2.- Lesiones del
compartimiento vascular fetal (LCVF, edema velloso,
trombosis vascular, vellosidades avasculares), 3.-
Inflamación23 (CH, corioamnionitis con vasculitis fetal
aguda (CVFA), vasculitis fetal aguda) y 4-. Otras lesiones
(aumento de la fibrina perivellosa [>10%}, villitis de
etiología desconocida con vasculopatía fetal obliterativa,
villitis de etiología desconocida multifocal sin
vasculopatia fetal obliterativa). Se incluyeron variables
sociodemográficas, obstétricas: gestas, diabetes,24
hipertensión arterial (HTA), preeclampsia,
eclampsia25,restricción de crecimiento intrauterino (RCIU),
ruptura prematura de las membranas (RPM), corioamnionitis
clínica, corticoides prenatales, y variables neonatales: EG
en semanas completas al parto por fecha de última
menstruación o ecografía del 1er trimestre, peso de
nacimiento (PN), pequeño para la edad gestacional (PEG, <
percentilo 10 de peso para la edad gestacional de la
referencia de la Maternidad Sardá),26 asfixia27,
reanimación cardiopulmonar neonatal (RCP),28 sindrome de
dificultad respiratoria (SDR), asistencia respiratoria
mecánica (ARM), ductus arterioso permeable (DAP), sepsis (hemocultivos
positivos), enterocolitis necrotizante (ECN) según
clasificación de Bell modificada29, ecografía cerebral
entre las 36 y 40 semanas de EG corregida, displasia
broncopulmonar (DBP, oxígeno más de 28 días)30, retinopatía
del prematuro (ROP) según la clasificación internacional31 y
examen neurológico anormal al egreso.
Todas las placentas se analizaron según técnica de fijación
en formol, inclusión en parafina y coloración de los cortes
con hematoxilina-eosina. El examen externo de placenta y
anexos incluyó: la valoración del peso y los diámetros del
disco placentario y su sección en cortes seriados. En la
superficie de corte se describieron y cuantificaron las
lesiones halladas. Se estudiaron histológicamente como
mínimo 4 tacos de parénquima placentario. De las membranas
ovulares se consignaron las características y anomalías
macroscópicas. El profesional de anatomía patológica (NM)
desconocía los resultados ecográficos.
La ecografía cerebral se realizó dentro de las primeras 72
horas con un equipo portátil Doppler Color, con transductor
de 7.5 mhz , utilizando cortes coronales y parasagitales a
través de la fontanela anterior con angulaciones a la
derecha e izquierda. Todos los estudios fueron realizados
por un médico ecografista (NB) quien desconocía los
resultados de la histopatología placentaria.
El análisis estadístico se realizó mediante la determinación
de medidas de tendencia central (media, mediana o
proporciones según correspondiera) y medidas de dispersión
(desvío estándar, intervalo de confianza al 95% de la
proporción y rango intercuartílico). El test U de Mann-Withney
y el test t de Student se utilizaron para la comparación de
variables continuas (mediana y media, respectivamente).
El riesgo biivariado se calculó mediante el estadístico Odds
Ratio (OR) y su intervalo de confianza al 95%. El test de
Chi2 o el test exacto de Fischer, cuando correspondiera, se
usó para la comparación de variables categóricas.
El potencial efecto confusor de variables independientes
sobre la asociación con las medidas preestablecidas de
resultados se exploró mediante la estratificación y modelos
de regresión logística múltiple. Se estimó la bondad del
ajuste de los modelos mediante el test de Hosmer-Lemeshow.
Un valor p menor de 0.05 (una cola) se consideró como
indicador de significación estadística. Se emplearon los
programas Statistica (versión 7, Statsoft, Tulsa, OK, USA),
Stata (versión 9.2, Lakeway Drive, Texas) y EPI-INFO
(versión 6.0, Stone Mountain, GA, USD Inc,).
De acuerdo con pautas de la OMS, en los estudios
epidemiológicos (tipo retrospectivo como el presente) en que
el numero de participantes es muy alto y que utiliza de
datos de historiales médicos, no se requiere consentimiento
informado.32
Resultados
En el período del estudio nacieron 44.175 RN vivos; de
ellos 628 (1,4%) fueron
£
1500 gramos y 361 (57.5 %)
cumplieron con los criterios de selección. Debido a la falta
de ecografía cerebral dentro de las 72 horas de vida (n=
22), ausencia de histopatología placentaria (n=63) y falta
de datos en la historia clínica neonatal (n=78) el número
final de pacientes incluidos fue de 198 (54,8%), 49 casos
(con lesiones US) y 149 controles (sin lesiones US).
En la Tabla 1 se describen las características
sociodemográficas y los antecedentes obstétricos según la
presencia o ausencia de lesiones ultrasonográficas dentro de
las 72 horas de vida. Las madres provenientes del Gran
Buenos Aires fueron un 20% más frecuentes en los casos (p =
0,053). El número de consultas prenatales estaba reducido
por la corta EG. Tanto la RPM (p = 0.027) como la
corioamnionitis clínica fueon más frecuentes en los casos.
|
TABLA
1. Características demográficas y antecedentes
obstétricos según la presencia o ausencia de
lesiones
ultrasonográficas cerebrales dentro de las 72 hs de
vida (Sardá, 2006-2012) |
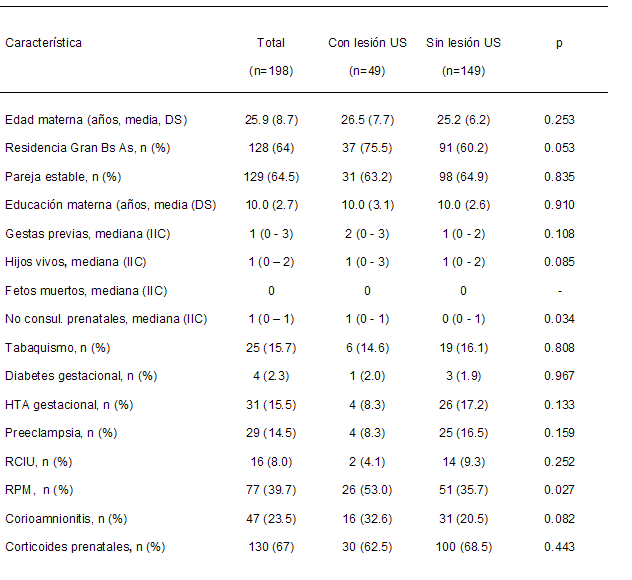 |
US:
ultrasonográfica
IIC: intervalo intercuartil
HTA:
hipertensión arterial
RCIU:
restricción del crecimiento intrauterino
RPM:
rotura prematura de membranas |
La Tabla 2 muestra características neonatales según la
presencia de lesiones ultrasonográficas. Tanto la EG como el
PN fueron estadísticamente menores en los casos que en los
controles. No hubo diferencias por sexos. Todas las
entidades fuertemente asociadas a prematurez (asfixia, RCP,
SDR, días de ARM, DAP, DBP, y mortalidad neonatal) fueron
estadísticamente más frecuentes en los casos. La ECN y el
examen neurológico anormal al alta fue el doble en los
casos, aunque sin alcanzar significación estadística,
probablemente por el escaso tamaño muestral. La ROP fue un
7,2% mayor en los casos.
| TABLA 2.
Características del Recién Nacido según la presencia
o ausencia de lesiones ultrasonográficas dentro de
las 72 hs de vida (Sardá, 2006- 2012) |
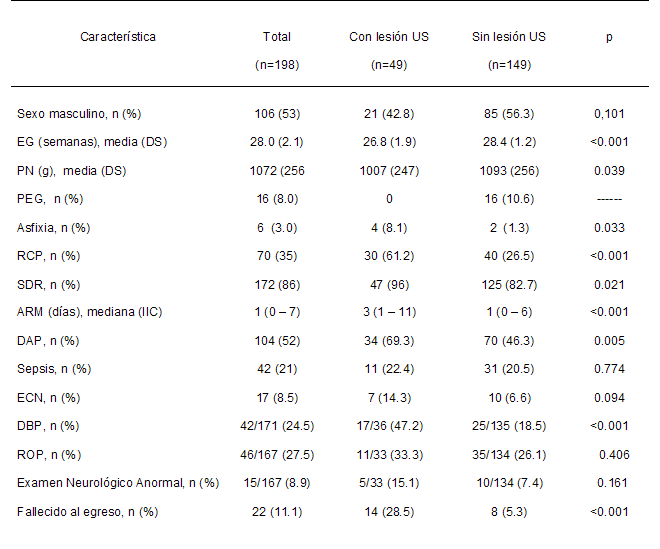 |
US: ultrasonográfica;
EG: edad gestacional;
PN: peso al nacer;
PEG: pequeño para la
edad gestacional (< percentilo 10) 26;
RCP: reanimación
cardiopulmonar;
SDR: síndrome dificultad
respiratoria;
ARM: asistencia
respiratoria mecánica;
DAP: ductus arterioso
permeable;
ECN: enterocolitis
necrotizante;
DBP: displasia
broncopulmonar;
ROP: retinopatía del
prematuro. |
La lesión ultrasonográfica más frecuentemente observada fue
la HIV, de las cuales casi un tercio eran graves. En el
resto no superaron el 10 %, aunque se destacan los amplios
intervalos de confianza. (Tabla 3)
|
Tabla 3.
Lesiones cerebrales dentro de las 72 hs de vida (Sardá,
2006-2012) |
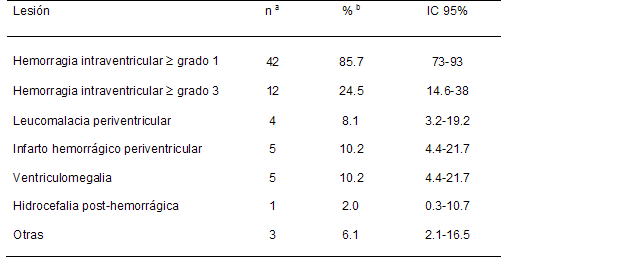 |
a: la
suma es mayor a 49 debido a la presencia de más de
una lesión por caso
b: la suma es mayor a 100 % debido a la presencia de
más de una lesión por caso
IC: intervalo de confianza.
|
La única entidad histológica asociada estadísticamente a
lesiones ultrasonográficas precoces en RNPT fue la
inflamación, con más del doble de riesgo en los casos (p=
0.020); de ésta la lesión más frecuentemente observada fue
la CVFA, 15% superior en los casos y marginalmente
significativa en comparación con los controles. El resto de
las lesiones no mostró diferencias entre ambos grupos.
(Tabla 4)
| Tabla 4.
Lesiones placentarias (n,%) según la ausencia o la
presencia de lesiones ultrasonográficas dentro de
las 72 hs de vida (Sardá, 2006-2012) |
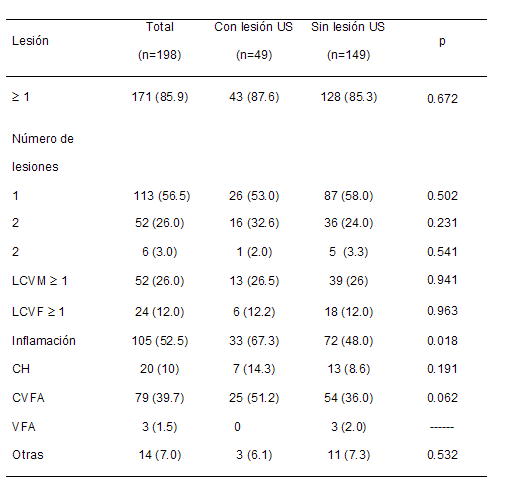 |
US: ultrasonografica;
LCVM: lesiones del
Compartimiento Vascular Materno;
LCVF: lesiones del
Compartimiento Vascular Fetal;
CVFA: corioamnionitis
con vasculitis fetal aguda;
CH: corioamnionitis
histológica;
CVFA: corioamnionitis
con vasculitis fetal aguda;
VFA: vasculitis fetal aguda.
|
Al ajustar por potenciales confundidores ninguna lesión
placentaria estuvo asociada a LIHC precoces. La EG mostró un
significativo efecto protector, ya que por cada semana de
incremento el riesgo de LIHC disminuía 30%. En contraste el
riesgo asociado a inflamación se redujo 4 veces (7.0 vs
1.72), manteniendo su significación estadística solamente en
el biivariado. (Tabla 5) El ajuste del modelo fue adecuado.
| TABLA 5.
Riesgos crudos y ajustados (IC 95%) por regresión
logística de lesiones ultrasonográficas dentro de
las 72 hs vida asociadas a lesiones placentarias (Sardá,
2006 - 2012) |
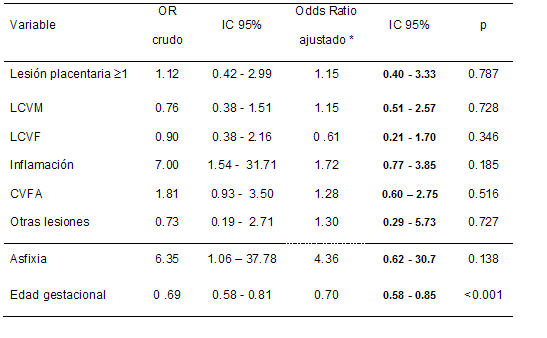 |
OR: odds ratio;
IC: intervalo de
confianza;
LCVM: lesiones del
Compartimiento Vascular Materno;
LCVF: lesiones del
Compartimiento Vascular Fetal;
CVFA: corioamnionitis
con vasculitis fetal aguda
* Ajustado para educación materna (años),
preeclampsia, corticoides prenatales, sexo,
edad gestacional y asfixia.
|
Discusión
Este es, de nuestro conocimiento, el primer estudio
latinoamericano que exploró la asociación entre lesiones
placentarias y la presencia de LIHC detectadas precozmente.
No se encontraron diferencias en las lesiones histológicas
placentarias entre los dos grupos luego del ajuste por
confundidores, aunque se pudo apreciar una mayor prevalencia
de lesiones inflamatorias en los casos (67.3%) en
comparación con los controles (48 %, p = 0.018).
La mayor frecuencia de RPM (p < 0.027) y corioamnionitis
clínica en los casos puede atribuirse a la mayor incidencia
de inflamación, en particular la CVFA en la placenta. Esto
coincide con otros reportes; un estudio de cohorte
prospectivo en el que se enrolaron 74 RNPT menores de 32
semanas y se midieron citocinas pro inflamatorias en sangre,
aquellos con RPM tenían niveles más elevados de citocinas y
las LIHC fueron más frecuentes.7
La frecuencia de HTA gestacional y preeclampsia fueron el
doble en los controles. Esta observación coincide con la de
otros autores en donde también se observó menor incidencia
de HIV grave en RNPT de madres con HTA gestacional que en
aquellos cuyas madres no presentaron HTA gestacional (p
0.001).33 No se sabe con certeza cuál es el mecanismo por
el cual la HTA gestacional puede reducir la incidencia de
HIV pero podría estar relacionado con una maduración
cerebral acelerada.34
La RCIU también fue el doble en los controles a diferencia
de otros reportes en donde se asoció con aumento de la
ecogenicidaded como expresión de LSBC.35 La discrepancia
puede atribuirse a que una proporción importante de RCIU en
nuestro estudio fue secundaria a HTA gestacional y
preclampsia.
Tanto la EG como el PN fueron estadísticamente menores en
los casos, en concordancia con la patogenia de la HIV y de
la LPV. En la Maternidad Sardá la incidencia de HIV y LPV
entre las 25 y 28 semanas de EG es del 13% y 4%
respectivamente, mientras que entre las 29 y 32 semanas es
del 4% y 0% respectivamente.36
Los PEG fueron exclusivamente controles lo cual pudo haber
sido secundario a la alta proporción de HTA y preeclampsia
en este grupo de pacientes (45%).
Casi todas las complicaciones neonatales y la mortalidad
fueron estadísticamente más frecuentes en los casos,
atribuible a su mayor inmadurez.
Dentro de las LIHC dentro de las 72 hs de vida (Tabla 3) la
HIV fue la más frecuente, siendo coincidente con la
epidemiología de las LIHC.4
Entre los sobrevivientes se observó que en el 50% de los
casos las LIHC persistían a las 36-40 semanas
postconcepcionales comparado con el 15.9% de los controles
(OR 5.39 (IC 95% 2.11 – 13.9, <0.001), a expensas de la HIV
(especialmente formas graves), LPV (p = 0.021) y VMG (p=
0.001) (datos no presentados). Esto coincide con otro
estudio en donde se destacó como complicaciones de las HIV a
la HPH y las LSBC.4
En el análisis bivariado se observó que de los cuatro
grupos de lesiones placentarias, la inflamación fue la única
asociada estadísticamente a LIHC y de éstas la CVFA fue la
más frecuente
(Tabla 5). Sin embargo cuando se ajustó por
potenciales confundidores ninguna lesión placentaria se
asoció a LIHC. Existen controversias en relación al rol de
la corioamnionitis como factor de riesgo, independientemente
de la edad gestacional, para resultados neurológicos
adversos. Recientemente el estudio multicéntrico ELGAN (Extremely
Low Gestational Age Newborn)13 proporcionó evidencia
epidemiológica a favor del rol de la inflamación prenatal en
las LSBC y parálisis cerebral (PC). El presente estudio
coincide en cuanto a la identificación de la inflamación
como la lesión más frecuentemente hallada en los casos, de
los cuales el 50% presentó ultrasonografía patológica a las
36-40 semanas, siendo la VMG la lesión predominante
(34.3%)
Harteman y col.14 comunicaron que los IHP detectados por
ultrasonografía en 46 pretérminos < 34 semanas de EG antes
de las 96 horas de vida se asociaron con CH (37%) y
funisitis (26%). En nuestra serie la presencia de IHP fue
muy baja a las 72 hs vida (10.2%).
Perrone y col.11analizaron prospectivamente la
histopatología de 105 placentas de RNPT entre 23 y 31
semanas, observando que los RNPT con inflamación placentaria
eran más pequeños y tenían más riesgo de desarrollar HIV
(p=0.002). También Moscuzza y col.15 incluyeron
retrospectivamente 122 pacientes entre 26 y 35 semanas y
encontraron mayor riesgo de HIV en los que tenían CH y
funisitis (p= 0.001). Sin embargo Sarkar y col.16 en un
estudio prospectivo con 62 RNPT 28 semanas no encontraron
asociación entre CH y HIV, lo que atribuyen a la alta tasa
de corticoides prenatales (90%).
En un estudio prospectivo que incluyó 628 RNPT 32 semanas
con un 48% de CH, si bien la CH se asoció a HIV severa no se
evidenció mayores compromisos en el neurodesarrollo en
relación a los controles.17 Chau y col 18 en un estudio
prospectivo con 92 RNPT entre 24 y 32 semanas de EG con
histopatología placentaria y resonancia magnética precoz y
al término, no evidenciaron asociación entre CH y LSBC.
La ventaja de nuestro trabajo es que se pudo evaluar la
asociación entre LIHC y lesiones placentarias detectadas por
los mismos operadores, lo que disminuyó la probabilidad de
error sistemático. La limitación es que por tratase de un
estudio retrospectivo hubo pérdida de información.
Conclusiones
Las LIHC son una importante complicación del RNPT. No se
encontraron diferencias en las lesiones histológicas
placentarias entre los dos grupos, aunque se observó una
clara prevalencia de lesiones inflamatorias en los
portadores de lesiones ultrasonográficas. La patología
placentaria en el RNPT con LIHC refleja enfermedades
subyacentes y condiciones clínicas que podrían interactuar
con los mecanismos patogénicos de las LIHC.
Bibliografía
1. Shalak L, Perlman J. Hemorrhagic-ischemic cerebral
injury in the preterm infant: current concepts. Clin
Perinatol 2002; 29(4): 745-63.
PubMed
2. Lomuto C. Situación de la Salud Perinatal: República
Argentina 2007. Rev Hosp Mat Inf Ramón Sardá 2009; 28(3):
135-44.
Full text
3. Grandi C, Rojas E, Solana C, Larguía M. Estadística
Neocosur, Hospital Materno infantil Ramón Sardá, 2009. Rev
Hosp Mat Inf Ramón Sardá 2009; 28(4): 171-77.
Full text
4. McCrea H, Ment L. The diagnosis, management and postnatal
prevention of intraventricular hemorrhage in the preterm
neonate. Clin Perinatol 2008; 35(4):777-92.
Full text
5. Khwaja O, Volpe J. Pathogenesis of cerebral white matter
injury of prematurity. Arch Dis Child Fetal Neonatal Ed.
2008; 93 (2):153-61.
PubMed
6. Back S, Riddle A, McClure M. Maturation-Dependent
Vulnerability of perinatal white matter in premature birth.
Stroke 2007; 38:724-30.
PubMed
7. Hansen-Pupp I, Harlin S, Berg A . Circulating interferon-gamma
and white matter brain damage in preterm infants. Pediatr
Res 2005; 58: 946-52.
PubMed
8- Porallaa C, Hertfelderb H, Oldenburgb J, Müllera A, et
al. Elevated interleukin-6 concentration and alterations of
the coagulation system are associated with the development
of intraventricular hemorrhage in extremely preterm infants.
Neonatology 2012;102:270–75.
PubMed
9. Ment L, Bada H, Barnes P, Grant P, et al. Practice
parameter: Neuroimaging of the neonate. Report of the
Quality Standards Subcommittee of the American Academy of
Neurology and the Practice Committee of the Child Neurology
Society. Neurology 2002;58:1726–38.
PubMed
10. Salafia C, Minior V, Rosenkrantz T, Pezzullo J, et al.
Maternal placental and neonatal associations with early
germinal matrix/intraventricular hemorrhage in infants born
before 32 weeks' gestation. Am J Perinatol
1995;12(6):429-36.
PubMed
11. Perrone S, Toti P, Toti M, Badii S, et al. Perinatal
outcome and placental histological characteristics: a
single-center study. J Matern Fetal Neonatal Med 2012;25
Suppl 1:110-13.
PubMed
12. Yoon B, Romero R, Yang S, Jun J, Kim I, et al.
Interleukin-6 concentrations in umbilical cord plasma are
elevated in neonates with white matter lesions associated
with periventricular leukomalacia. Am J Obstet Gynecol 1996;
174:1433–40.
PubMed
13. Leviton A, Allred E, Kuban K, Hecht J, et al.
Microbiologic and histologic characteristics of the
extremely preterm infant’s placenta predict white matter
damage and later cerebral palsy. The ELGAN study. Pediatr
Res 2010; 67: 95–101.
PubMed
14. Harteman J, Nikkels P, Kwee A, Groenendaal F, et al.
Patterns of placental pathology in preterm infants with a
periventricular haemorrhagic infarction: Association with
time of onset and clinical presentation. Placenta 2012; 33:
839-44
PubMed
15. Moscuzza F, Belcari F, Nardini V, Bartoli A, et al.
Correlation between placental histopathology and
fetal/neonatal outcome: chorioamnionitis and funisitis are
associated to intraventricular haemorrage and retinopathy of
prematurity in preterm newborns. Gynecol Endocrinol
2011;27(5):319-23.
PubMed
16. Sarkar S, Kaplan C, Wiswell T, Spitzer A. Histological
chorioamnionitis and the risk of early intraventricular
hemorrhage in infants born 28 weeks gestation. J Perinatol
2005; 25749–52.
PubMed
17. Hendson L, Russell L, Robertson C, Liang Y, et al.
Neonatal and neurodevelopmental outcomes of very low birth
weight infants with histologic chorioamnionitis. J Pediatr
2011;158(3): 397- 402.
PubMed
18. Chau V, Poskitt K, McFadden D, Bowen-Roberts T, et al.
Effect of chorioamnionitis on brain development and injury
in premature newborns. Ann Neurol 2009 Aug;66(2):155-64.
PubMed
19. Govaert P, De Vries L. An Atlas of Neonatal Brain
Sonography. London: MacKeith Press; 1997.
20. Bassan H, Benson C, Limperopoulos C, Feldman H, et al.
Ultrasonographic features and severity scoring of
periventricular hemorrhagic infarction in relation to risk
factors and outcome. Pediatrics 2006;117(6):2111-18.
PubMed
21. Papile L, Burstein J, Burstein R, Koffler H. Incidence
and evolution of subependymal and intraventricular
hemorrhage: a study of infants with birth weights less than
1,500 gm. J Pediatr 1978;92:529-34.
PubMed
22. Redline R. Placental pathology: a systematic approach
with clinical correlations. Placenta 2008; 29 Suppl A :
86-91.
PubMed
23. Redline R. Inflammatory response in acute
chorioamnionitis. Semin Fetal Neonatal Med 2012;17(1):20-25.
PubMed
24. Basualdo M, Di Marco I, Bourlot B, Ramirez M, et al.
Diabetes y embarazo: Guía de Práctica Clínica. Maternidad
Sardá. 2010. [Disponible en:
ttp://www.sarda.org.ar/Profesionales/Guias_y_Trabajos/Guias_de_Practica_Clinica/Diabetes_y_embarazo_Abril_2010_-_Diabetes_Gestacional ]
[Consulta: 11 de marzo de 2013].
25. Lapidus A et al. Guía para el diagnóstico y tratamiento
de la Hipertensión en el Embarazo. Dirección Nacional de
Maternidad e Infancia, Min.Salud. Argentina,2da edición
2010. [Disponible en:
www.msal.gov.ar/promin/archivos/pdf/Guia_Hipertension.pdf
] [Consulta: 13 de febrero
de 2013].
26. San Pedro M, Grandi C, Larguía M, Solana C. Estándar de
peso para la edad gestacional en 55706 recién nacidos sanos
de una maternidad pública de Buenos Aires. Medicina (Buenos
Aires) 2001; 61:15-22.
27. American Academy of Pediatrics and American College of
Obstetricians and Gynecologists. Care of the neonate. In:
Gilstrap L, Oh W, editors. Guidelines for Perinatal care.
5th ed. Elk Grove Village (IL): American Academy of
Pediatrics; 2002: 187-98.
28. American Heart Association/ American Academy of
Pediatrics. Manual de Reanimación Neonatal. 5ta ed, American
Heart Association, 2006
29. Rabasa C. Enterocolitis necrotizante. En Martinez Ferro
M, ed. Neonatología quirúrgica. Buenos Aires, Argentina:
Grupo Guía SA; 2004: 527-44.
30. Bancalari E, Claure N, Sosenko I. Bronchopulmonary
dysplasia: changes in pathogenesis, epidemiology and
definition. Semin Neonatol 2003; 8, 63–71.
PubMed
31. Benitez, A, Visintin P. Que es la retinopatía del
prematuro. En Prevención de la ceguera en la infancia por
retinopatía del prematuro. Buenos Aires, Ministerio de Salud
de la Nación y UNICEF, 2008: 12-19.
32. Organización Mundial de la Salud. Consejo de
Organizaciones Internacionales de las Ciencias Médicas (CIOMS).
Pautas Internacionales para la Evaluación Ética de los
Estudios Epidemiológicos. Ginebra,1991.
33. Perlman J, Risser R, Gee J. Pregnancy induced
hipertension and reduced intraventricular hemorrhage in
preterm infants. Pediatr Neurol 1997; 7: 29-33.
PubMed
34. Hamid A. Fetal cerebral maturation in hipertensive
disorders of pregnancy. Obstet Gynecol 1984;63: 214 -19.
PubMed
35. McElrath T, Allred E, Boggess A, Kuban K, et al.
Maternal antenatal complications and the risk of neonatal
cerebral white matter damage and later cerebral palsy in
children born at an extremely low gestational age. Am J
Epidemiol 2009;170:819 –28.
PubMed
36. Grandi C, Rojas E, Solana C, Larguía M. Estadísticas
NEOCOSUR del Hospital Materno Infantil Ramón Sardá" 2009.
Rev Hosp Mat Inf Ramón Sardá 2010; 29(4): 171-77.
Full text
|
|