ARTÍCULOS DE REVISIÓN
Seguridad de los beta 2 agonistas (β2a) en
asma bronquial
Safety of beta-agonists
in asthma
Teodoro J Oscanoa1
Revista Facultad de Ciencias Medicas 2014; 71(1):43-53
Centro de trabajo: (1)
Sección de Farmacología de la Facultad de Medicina de la
Universidad Nacional Mayor de San Marcos. Lima. Perú.
Instituto de Investigaciones de la Universidad San Martin de
Porres. Lima.
Jefe del Departamento de Medicina Interna del Hospital
Almenara. Lima. Perú
Nombre y dirección completa del autor responsable de la
correspondencia:
Dr. Teodoro J. Oscanoa. Dirección: Servicio de Geriatría del
Hospital Almenara.
Av. Grau 800. Lima 13. LIMA PERU. Teléfono: 324 2983 anexo
4085. Correo
Electrónico:
tjoscanoae@gmail.com
tjoscanoae@unmsm.edu.pe ,
Becas o ayudas para la subvención del trabajo: ninguna.
conflictos de interés: Ninguna.
Teléfono: 324 2983 anexo 44081. Correo Electrónico:
toscanoae@usmp.pe
tjoscanoae@unmsm.edu.pe ,
Introducción
La terapia broncodilatadora para el asma más antigua
conocida por la humanidad se inicia hace más de 5000 años,
con la planta Ma Huang (Ephedra) de la Medicina
China. El principio activo de la Ephedra es la efedrina que
libera catecolaminas endógenas causando broncodilatación. En
1907 se demostró experimentalmente el efecto broncodilatador
de la adrenalina, el cual fue la base terapéutica para su
aplicación subcutánea en la crisis asmática, posteriormente
un médico británico describió la vía de administración por
nebulización. Durante la década de los 1940 se sintetiza el
isoproterenol y se comienza a distinguir la diferencia en la
respuesta bronquial al isoproterenol y noradrenalina,
naciendo el concepto de receptores adrenérgicos alfa y beta.
En la década de 1960, se descubre que las aminas
simpaticomiméticos podría actuar sobre receptores beta 1 y
beta 2, una subdivisión basada en su acción preferente sobre
el corazón y las musculatura lisa bronquial. Lands y col
descubrió que la isoetarina era altamente selectiva a los
receptores beta 2. La aplicación clínica de isoetarina fue
difícil y poco exitosa, debido a su vida media muy corta,
por el rápido metabolismo asociado a su anillo catecol. En
año 1968 David Jack and Roy Brittain sintetizan el
salbutamol, fármaco broncodilatador beta 2 agonista, que
revolucionó la terapéutica del asma bronquial y es utilizado
ampliamente hasta la actualidad. Salbutamol es un fármaco de
diseño exitoso, tiene su origen en el isoproterenol, donde
el grupo hidroxilo fue deliberadamente reemplazado por un
grupo hidroximetil con el objetivo de resistir su
destrucción por la catecol-O-metil transferasa (COMT).1
Los dos grandes aportes a la terapia del asma de Brittain y
Jack, se completaría en 1990 cuando logran sintetizar el
salmeterol, el primer beta 2 agonista de acción prolongada y
ponerlo a disposición para su uso clínico; este fármaco
tiene una cadena lateral extendida que lo convierte en
10,000 veces más lipofilo que salbutamol. En perspectiva, la
historia de los β2A, actualmente parece empeñada
en prolongar aun más la vida media, en esta línea el año
2006 se inicia los estudios de fase III del indacaterol uno
de los representantes más conspicuos de una nueva línea de β2A,
ahora denominados “de acción ultraprolongada”, con una
duración de acción de 24 horas, posibles de usarlos una vez
por día.2
Musculo liso bronquial
La fisiopatología del asma bronquial tiene dos componentes
esenciales, el broncoespasmo y el proceso inflamatorio. Como
el efecto principal de los β2A es la
broncodilatación, la diana de este grupo farmacológico es el
musculo liso bronquial (MLB). El MLB es la estructura que
gobierna el control del calibre de las vías aéreas, su tono
muscular es el resultado del balance entre estímulos
constrictores y relajantes.3 La modulación del
tono bronquial normal está a cargo del sistema nervioso
autónomo. El sistema autónomo simpático actúa sobre el tono
del MLB como broncodilatador. En el ser humano no hay
inervación simpática directa sobre el MLB, la activación de
los receptores β2 del MLB ocurre por las
catecolaminas circulantes.
La inervación parasimpática, fundamentalmente de acción
broncoconstrictora, tiene lugar porque el MLB tiene
receptores muscarínicos. Bajo este principio, a lo largo de
la historia se ha tratado de explotar la acción
broncodilatadora de los fármacos que bloquean los receptores
muscarínicos, entre los que se cuentan, belladona,
estramonio y la misma atropina sin gran éxito. En 1984 se
descubrió subtipos de receptores muscarínicos,
reconociéndose que los receptores M3 son lo que gobiernan
los efectos broncoconstrictores del tono colinérgico del MLB,
mientras que los receptores M2 funcionaban como receptores
de retroalimentación inhibitoria (autoreceptores). Este
descubrimiento abrió las puertas para la síntesis de
antagonistas selectivos M3 como son bromuro de ipatropio
(broncodilatador antimuscarínico de acción corta) y el
tiotropio (broncodilatador muscarínico de acción
prolongada).1 fármacos inhalatorios ampliamente
utilizados en enfermedad pulmonar obstructiva crónica y asma
bronquial.
En estado normal también existen sistemas diferentes del
sistema nervioso autónomo que regulan el tono del MLB, como
el oxido nítrico, aunque su contribución es mínima. En asma
bronquial, la bronconstricción tiene otros mediadores,
dentro de los más conocidos están las que causan respuesta
bronconstrictora precoz o inmediata (10 a 90 minutos) como
la histamina que actúa sobre los receptores H1
del MLB. Esta respuesta precoz es seguida por una segunda
fase bronconstrictora tardía que puede durar horas o días,
esto es mediado por leucotrienos (C4, D4 y E4) que actúan
sobre los receptores cys-LT1 del MLB. Se han desarrollado
antagonistas de los receptores de leucotrienos (CysLT1) como
el montelukast, pranlukast y zafirlukast, también debe
incluirse a un inhibidor de la 5-lipoxygensa que es el
zileuton.4
Farmacodinamia
Los β2A actúan uniéndose a los receptores β2
del músculo liso bronquial, dichos receptores son miembros
de la familia de receptores que presentan 7 dominios
transmembrana y están acoplados a proteína G. Los receptores
β2 están presentes en alta densidad en las
células musculares lisas, sin embargo también están
presentes en otros tejidos que forman parte del aparato
respiratorio como glándulas submucosa, células del epitelio
respiratorio, endotelio vascular, mastocitos, células
inflamatorias circulantes como eosinofilos y linfocitos,
pneumocitos tipo II y ganglios colinérgicos.5 Por
consiguiente, se han atribuido los siguientes efectos,
aparte de la broncodilatacion de las vías aéreas distales y
proximales: inhibición de la liberación de mediadores de los
mastocitos, inhibición de la exudación plasmática y edema de
las vías aéreas, incremento de la depuración mucociliar,
incremento de la secreción de moco, disminución de la
neurotransmisión colinérgica y disminución de la tos.6
Los β2A se clasifican según su duración de
acción, selectividad y afinidad hacia el receptor, potencia
y eficacia. Salbutamol y formoterol tiene más rápido inicio
de acción que salmeterol; salmeterol y formoterol tienen una
duración de acción mayor que salbutamol, debido a su
propiedad lipofilica producen efecto de depósito a nivel de
la membrana celular, de manera que es posible administrarse
dos veces al día. Los β2A son moderada y
altamente selectivos a los receptores β2. La
afinidad se refiere a la atracción entre los agonistas y su
receptor y se expresa como una constante de disociación
entre agonistas y el receptor. La potencia se refiere a la
concentración de la droga que alcanza la mitad de la
respuesta máxima del cual el fármaco es capaz (EC50) y
depende fundamentalmente de la afinidad y eficacia
intrínseca del fármaco.
La eficacia intrínseca se define como la relación
eficacia/número total de receptores, es decir, es la
capacidad de medicamento de activar su receptor, sin tener
en cuenta su concentración o número de receptores. El modelo
de receptor en dos estados es útil para definir agonistas
completos, parciales e inversos; este modelo presenta a los
receptores ligados a proteína G en dos estados en
equilibrio, una forma inactiva (R) y conformación activa
espontanea (R*). Los agonistas clásicos tienen una alta
afinidad para la forma R* comparado con la forma R, por
tanto se incrementa la concentración de R*. Bajo este modelo
la eficacia intrínseca se define como relativa preferencia
de afinidad de los ligando por R* y R. Los fármacos con un
alto grado de eficacia (agonistas completos) tienen mucha
mayor afinidad por R* que por R; mientras que los fármacos
con eficacia intrínseca baja (agonistas parciales) tienen
relativamente una menor afinidad por R* que por R. Entre los
agonistas de los receptores β2 disponibles, la
epinefrina tiene la más alta eficacia intrínseca, seguido de
formoterol, salbutamol y salmeterol, este último tiene la
menor eficacia intrínseca. Indacaterol, uno de los mas
recientes β2A, tienen una eficacia intrínseca
similar al formoterol.2 Con este mismo modelo, un
agonista inverso (eficacia intrínseca negativa) tiene una
alta afinidad mayor para la conformación R que la forma R*,
por consiguiente disminuye la concentración de R*,
ejerciendo un efecto totalmente opuesto al agonista. Los
antagonistas competitivos neutrales tienen una afinidad
igual para R y R* y no desplazan el equilibrio entre ambos,
pero antagonizan competitivamente los efectos tanto de
agonistas como de agonistas inversos.5
Seguridad de los broncodilatadores beta 2 agonistas (β2A)
Seguridad de los broncodilatadores β2A de acción
corta (Short-Acting β2 Agonists o SABAs).
Tres son los aspectos relevantes de seguridad a discutir
con los SABAs: indicios de relación con asma fatal que no es
un efecto de clase (aparentemente solo con isoproterenol y
fenoterol); la diferencia significativa de eventos adversos
cuando se administra salbutamol inhalatorio en forma
continua vs a demanda y la influencia de los polimorfismos
genéticos.
La historia de los SABAs registra dos epidemias de asma
fatal ocurridas en Inglaterra en 1961 y en Nueva Zelanda en
1977. La incidencia de asma fatal en Inglaterra hasta 1961
se había mantenido en 0.5 por 100,000 personas, a partir de
ese año se incrementó progresivamente hasta llegar cerca a 3
por 100,000 personas, similar tendencia se observó en
Escocia, Australia e Irlanda. La hipótesis más aceptada
sobre la causa de estos hechos fue el uso y abuso del
isoproterenol en aerosol a elevada concentración. Un hecho
importante que reforzó esta hipótesis, fue que esta
epidemia no ocurrió en Estados Unidos ni Canadá, países
donde esta forma farmacéutica nunca se autorizó su venta.7,8,9
En 1977 se reportó otra epidemia en Nueva Zelanda que llegó
a cifras 3 veces mayores de incidencia de asma fatal que el
Reino Unido en ese mismo periodo de tiempo.10 Al
analizar esta epidemia, se observó una coincidencia temporal
con la introducción de fenoterol en Nueva Zelanda y la tasa
de mortalidad de asma fatal se mantuvo entre las más altas
del mundo durante más de una década; adicionalmente la
epidemia desapareció cuando en 1990 se publicaron estudios
de casos y controles sobre la seguridad del fenoterol.11,12,13
Ver tabla 1
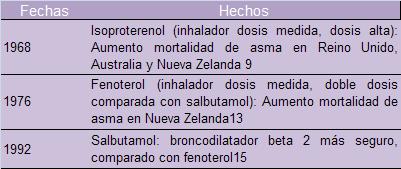 |
Sobre la evolución y cronología de los hechos en relación
con la seguridad de los broncodilatadores β2A de
acción corta. Los mecanismo fisiopatológicos de la
asociación de asma fatal con isoproterenol y fenoterol es
desconocida, sin embargo, aparentemente es la confluencia de
varios factores, entre las cuales están la
broncoconstricción e hiperreactividad bronquial de rebote
que ocurre al suspender estos SABAs. El uso diario de
fenoterol está asociado con una reducción de flujo pico
matutino, lo que sugiere que
el intervalo
entre las dosis durante la noche
es suficiente para permitir
la broncoconstricción de
rebote. Este fenómeno no se observa con
salbutamol. El uso regular de SABAs conduce a tolerancia de
sus efectos broncoprotectores y brondilatadores. La
tolerancia se hace más evidente cuando empeora la
broncoconstricción; en asma severa esto puede conducir a una
pobre respuesta al tratamiento de emergencia. El asma fatal
asociada con fenoterol e isoproterenol seria el resultado de
un efecto de rebote del asma y pobre respuesta a estos SABAs
como consecuencia de fenómeno de tolerancia; ambos efectos
serian causados por regulación decreciente (downregulation)
de los receptores β2 los cuales
ocurren con todos los β2 agonistas.14
Se ha demostrado que salbutamol inhalatorio usado “cuando
sea necesario o a demanda” es más eficaz y seguro que cuando
se usa en forma regular o continua.15 Los
estudios de Taylor y col han evidenciado que el uso de
salbutamol en forma continúa está relacionado con
declinación en el volumen espiratorio forzado en el primer
segundo (FEV1), mas variación diurna
del flujo espiratorio máximo
(PEF) y mayor sensibilidad
a la metacolina.16 Por otro lado, el estudio de
Drazen y col sobre este mismo tópico, no mostró ninguna
diferencia significativa entre las variables evaluadas
(Variabilidad del PEF, FEV1 , número de puffs de salbutamol
o síntomas) entre uno u otra forma de administración.17
Los estudios farmacogenómicos (estudio de las variaciones
de las características del ADN y ARN en relación con la
respuesta al fármaco) y farmacogenéticos (parte de la
farmacogenómica que estudia las variaciones de la secuencia
de ADN relacionados a la respuesta al fármaco)18
del asma se han focalizado en los determinantes genéticos de
la reversibilidad broncodilatadora y el empeoramiento del
asma con el uso continuo de los SABAs. El gen del receptor
adrenérgico β2 (ADRB2) tiene de 80 polimorfismos,
habiéndose validado 45 SNP (Single nucleotide
polymorphism) y dos inserciones/deleciones. Los estudios
se han centrado sobre todo en el polimorfismo Gly16Arg
(variante de aminoácidos glicina/arginina en la posición
16). Un estudio retrospectivo del los datos del Mild
Asthma Trial 19 encontró que los individuos
con el polimorfismo B16 Arg/Arg que recibieron albuterol en
forma regular tuvieron más exacerbaciones.20
Adicionalmente el estudio BARGE (β Adrenergic Response by
GenotypE) que investigó el esquema de uso regular vs
“cuando sea necesario” de albuterol, evidenció que los
pacientes con B16 Arg/Arg presentaban menor
PEF que aquellos con placebo o albuterol
administrado regularmente pero con B16 glicina/glicina (que
mejoraron cuando se retiro SABAs y se sustituyó con
Ipatropio). De los datos disponibles, es posible concluir
que los pacientes con polimorfismo B16 Arg/Arg son
más susceptibles a los efectos de la administración de SABAs,
especialmente cuando su uso es continuo.21
En relación con los aspectos de seguridad de los SABAs como
salbutamol puede calificarse como seguro, su lugar en la
terapéutica del asma es como medicamento de rescate que
alivia el broncoespasmo, previene el asma del ejercicio y el
tratamiento de las exacerbaciones. No se recomienda su uso
en forma regular, sino a demanda; existen indicios que
sugieren su relación con ciertos polimorfismos donde el
efecto deletéreo de su uso regular es más pronunciado que
otros, sin embargo su real impacto en la práctica diaria es
incierto, mientras no se emplee en forma rutinaria esta
tecnología para la selección de los pacientes.
Seguridad de los broncodilatadores β2A de acción
prolongada (Long-Acting β2 Agonists o LABAs).
Actualmente en los referente a los aspectos de seguridad de
los LABAs se vive un verdadero fenómeno de
Déjà vu (del
francés, fenómeno de lo “ya visto”), puesto que parece que
la historia descrita para los SABAs pareciera repetirse8
, aunque algo atenuada, pero con claros indicios de
estar asociados a eventos severos de asma incluyendo
elevación de la mortalidad. Dada la magnitud y seriedad de
problema, se reseñarán los hechos de la siguiente manera:
seguridad de los LABAs administrado en forma aislada,
asociada a corticoides, hipótesis sobre mecanismos
fisiopatológicos implicados y argumentos en favor o en
contra sobre esta controversia.
Sobre la seguridad de los LABAs, actualmente lo único que
esta fuera de cualquier controversia es que dichos fármacos
no se deben administrar de forma aislada, es decir, se debe
evitar la monoterapia con un LABA.
Debe recordarse que los LABAs se expendían hasta hace pocos
años en inhaladores conteniendo solo el principio activo (salmeterol
o formoterol) y actualmente existen inhaladores que combinan
estos fármacos con corticoides inhalatorio en el mismo
envase.
En el año 2005 la FDA ya había lanzado una advertencia de
recuadro negro (black box warning) sobre este tópico.22,23
En diciembre de 2008 un comité especial de la FDA determinó
que los LABAs Salmeterol (Serevent, GlaxoSmithKline)
y formoterol (Foradilde Novartis) no deben ser
utilizados en el tratamiento del asma para todas las edades,
porque los riesgos superan sus beneficios24
a raíz de esta recomendación de la FDA ya se han sumado
convocatorias para el retiro de LABAs que no estén asociados
con corticoides.25
La decisión de la FDA se fundamenta en numerosos ensayos
clínicos que se inician desde 1993, cuando Castle y col (Salmeterol
Nationwide Surveillance o SNS)26 encontraron
un incremento de la mortalidad (estadísticamente no
significativo) en el grupo de salmeterol vs salbutamol de
0.07% y 0.02% (p= 0.105) respectivamente; debe anotarse que
salmeterol fue aprobado por la FDA en 1994 a pesar de esta
última evidencia. Con el fin de disipar las dudas sobre la
seguridad de los LABAs que figuraban en su partida de
nacimiento, se diseñaron una serie de estudios entre los más
conocidos están el SMART (Salmeterol Multi-center Asthma
Research Trial)27 y FACET (Formoterol and
Corticosteroids Establishing Therapy)28, entre
muchos otros. Se han realizado también varios estudios
metanaliticos 29,30,31, seguido de
pronunciamientos actualizados periódicamente de la FDA sobre
este tópico. Ver tabla 2 sobre seguridad de los LABAs,
evolución y cronología de los hechos.
 |
Aclarado el tema de los riesgos de la monoterapia con LABAs,
se tuvo la impresión que esta historia ya tenía un honroso
final, con la idea que la administración de LABAs
asociados con corticoides reunía los perfiles de seguridad
idóneos, sin embargo, el mismo comité especial de la FDA en
el año 2008, en vista de algunos indicios nada auspiciosos
sugirió evaluar mas exhaustivamente los aspectos de
seguridad de las formas de presentación mixta (LABAs+corticoides).32,33
Cumpliendo las sugerencias de la FDA se realizaron hasta 6
estudios metaanalíticos publicados hasta el 2011, cinco de
ellos concluyen que la asociación con corticoides no elimina
totalmente el riesgo de eventos catastróficos (intubación o
mortalidad) asociada a asma.34-39 Dentro de estos
estudios metaanalíticos señalados, se encuentra el realizado
por la misma FDA y publicado en el año 2011 por McMahon y
col donde se evidenció que los eventos severos relacionados
a asma asociados a LABAs eran más frecuentes en niños de 4 a
11 años de edad. 39 El metaanálisis de Rodrigo y
col fue el único que demostró que la terapia combinada
reduce exacerbaciones y hospitalizaciones y es equivalente a
monoterapia con corticoides en términos de mortalidad por
asma.37 (Ver tabla 2). Ante estas evidencias la
FDA el 15 de abril del 2011 emite una alerta de seguridad
con nuevas recomendaciones para el uso de los LABAs
asociados a corticoides.40 (Ver tabla 3 ) sobre
nuevas recomendaciones de la FDA para el uso seguro de los LABAs.
 |
Los mecanismos fisiopatológicos que se han esbozado para
explicar la denominada “paradoja de los β2
agonistas”, es decir el incremento del riesgo de
exacerbación del asma en un grupo de pacientes con el uso de
LABAs, se pueden clasificar en dos fundamentales:
disminución en el efecto relajante del musculo liso
bronquial a los LABAs (desensibilización del receptor β2A)
e incremento en su respuesta broncoconstrictora por
interacción heterológa entre receptores (hipótesis de la
teoría del “remodelamiento bioquímico” del musculo liso
bronquial) 41-42 , el primero presenta evidencias
en humanos y el segundo en animales de experimentación. El
uso simultaneo de corticoides inhalados reduciría la
reactividad de las vías aéreas el cual se traduciría en
cierto efecto protector de eventos catastróficos
relacionados a asma.38
El debate sobre la seguridad de los LABAs asociados a
corticoides, actualmente se encuentra en su punto más
álgido, existen argumentos en pro y en contra que se han ido
discutiendo en estos últimos años, algunos de los cuales se
analizará brevemente. El primer argumento minimiza las
evidencias de mortalidad relacionado con LABAs porque a
pesar de haber sido mayor en el grupo con LABAs, en la
mayoría de estudios, estos han resultado ser
estadísticamente no significativos. Sin embargo, debe
anotarse que los estudios realizados para aclarar este
problema, han tenido sesgos que tienden más en el sentido de
la minimización de la mortalidad, que lo contrario. Por
ejemplo los análisis se han hecho solo en un subgrupo de
pacientes del total disponible, incluyendo solo ensayos
clínicos con salmeterol, formoterol, adultos, muertes por
asma, reporte de eventos publicados, ensayos clínicos
provenientes de los mismos patrocinadores de los fármacos
aludidos o exclusivamente a dosis aprobadas por la FDA.38
El segundo argumento bien podría resumirse en un dicho
popular: “los arboles nos impiden ver el bosque”, es decir,
el debate sobre el incremento de mortalidad que en la
mayoría de los estudios no ha sido estadísticamente
significativo, nos está impidiendo “ver” el efecto que ha
tenido la introducción de este grupo farmacológico a la
mortalidad de asma como aporte a la salud pública: desde
1990 existe una clara tendencia a la disminución de la
mortalidad relacionado con asma a nivel mundial. En realidad
en este periodo de tiempo también los corticoides
inhalatorios han extendido su uso, por consiguiente, no se
puede atribuir la disminución de la mortalidad por asma
exclusivamente al uso de los LABAs.38 El tercer
argumento deriva del segundo, el incremento progresivo en la
venta de los LABAs no ha afectado la tendencia decreciente
mundial de disminución de la mortalidad relacionado a asma.
Nuevamente los corticoides inhalatorios también han tenido
una tendencia a la elevación en su uso y comercialización,
aunque con una gran diferencia con los LABAs, la tendencia
creciente al uso de corticoides inhalatorios es mucho más
elevada y rápida.
Las
repercusiones sobre la seguridad de los LABAs han sido
tomadas en cuenta en las ultimas guías de práctica clínica
sobre asma; así, la versión actualizada al 2011 del
Global Initiative for Asthma (GINA), pone como opción
terapéutica recién en el 3er paso (de un total de 5), como
fármaco controlador de elección en la prevención de las
exacerbaciones en el paciente asmático; previamente debe
haberse probado con corticoides inhalatorios o con
antileucotrienicos.43 La guía británica revisada
al 2011, igualmente recomienda usar un LABA recién en el 3er
paso (de un total de 5), siempre asociado a la terapia
corticoidea inhalatoria, sin embargo anota que de no
obtenerse una buena respuesta, debería suspenderse el LABA e
incrementarse la dosis de corticoide inhalatorio a
800ucg/día o agregar un antileucotrienico.44
Conclusiones
En la farmacoterapia del asma los broncodilatadores beta 2
agonistas han resultado en un aporte importante en la
calidad de vida de los pacientes con asma bronquial. Las
evidencia sobre la seguridad de los SABAs inhalatorios, como
el salbutamol, usados a demanda o como fármaco de rescate,
tiene un aceptable balance riesgo-beneficio. Los LABAs no
deberían ser usados como monoterapia por estar relacionados
con elevación de mortalidad en pacientes asmáticos de
cualquier edad. Actualmente se encuentra en debate los
aspectos de seguridad de los LABAs asociados a corticoides,
por consiguiente su prescripción en un paciente asmático
será valorando el riesgo vs beneficio, especialmente
evaluando y comparando otras opciones como incremento de
dosis de corticoides y otras medidas de intervención
farmacológica de control y prevención de la exacerbación de
los accesos asmáticos.
Referencias
1.
Barnes PJ.Drugs
for asthma.
Br J
Pharmacol.
2006 Jan;147 Suppl 1:S297-303…
2.
Cazzola M,
Segreti A,
Matera MG.
Novel bronchodilators in
asthma.
Curr Opin
Pulm Med.
2010 Jan;16(1):6-12.
3.
Hall IP.Second
messengers, ion channels and pharmacology of airway smooth
muscle.
Eur Respir
J.
2000 Jun;15(6):1120-7.
4.
Drazen JM,
Israel E,
O'Byrne PM.Treatment
of asthma with drugs modifying the leukotriene pathway.
N Engl J
Med.
1999 Jan 21;340(3):197-206.
5.
Hanania NA, Dickey BF, Bond RA.
Clinical implications of the
intrinsic efficacy of beta-adrenoceptor drugs in asthma:
full, partial and inverse agonism.
Curr Opin Pulm Med. 2010
Jan;16(1):1-5. Review.
PubMed
6.
Donohue JF. Safety and efficacy of beta2 agonists.
Respir Care 2008;
53(5):618-622;
Full Text
7.
Stolley PD. Asthma mortality: why the United States was
spared an epidemic of deaths due to asthma. Am Rev Respir
Dis 1972;105(6):883–890.
8.
O’Byrne PM, Adelroth E. Beta2 déjà vu.
Chest 2006;129:3-5.
PubMed
9.
Speizer FE, Doll R, Heaf DP, et al. Investigation into the
use of drugs preceeding death from asthma. BMJ 1968;
1:229–243
Full text
10.
Jackson RT, Beaglehole R, Rea HH, Sutherland DC. Mortality
from asthma: a. Mortality from asthma: a new epidemic in New
Zealand.
Br Med J 1982;285:771-4.
Full Text
11.
Grainger J,
Woodman K,
Pearce N,
Crane J,
Burgess C,
Keane A,
Beasley R.
Prescribed fenoterol and death
from asthma in New Zealand, 1981-7: a further case-control
study..
Thorax.
1991 Feb;46(2):105-11.
12.
Pearce N, Beasley R, Crane J, Burgess C, Jackson R. End of
the New Zealand asthma mortality epidemic. Lancet
1995;345(8941):41–44.
Abstract
13.
Crane J, Pearce N, Flatt A, et al. Prescribed fenoterol and
death from asthma in New Zealand, 1981–83: case-control
study. Lancet 1989; 1:917–922
PubMed
14.
Hancox RJ. Concluding remarks: can we explain the
association of beta-agonists with asthma mortality? A
hypothesis. Clin Rev Allergy Immunol 2006;31(2-3):279–288.
PubMed
15.
Spitzer WO, Suissa
S, Ernst
P, Horwitz
RI, Habbick
B, Cockcroft
D, Boivin
JF, McNutt
M, Buist
AS, Rebuck
AS.
The use of beta-agonists and the risk of death and near
death from asthma.
N Engl J Med. 1992
Feb 20;326(8):501-6.
16.
Taylor DR, Sears MR, Herbison GP, Flannery EM, Print CG,
Lake DC, Yates DM, Lucas MK, Li Q.
Regular inhaled beta agonist in
asthma: effects on exacerbations and lung function.
Thorax. 1993 Feb;48(2):134-8.
Full Text
17.
Drazen JM, Israel E, Boushey HA, Chinchilli VM, Fahy JV,
Fish JE, Lazarus SC, Lemanske RF, Martin RJ, Peters SP,
Sorkness C, Szefler SJ.
Comparison of regularly
scheduled with as-needed use of albuterol in mild asthma.
Asthma Clinical Research Network.
N Engl J Med.
1996 Sep 19;335(12):841-7.
18.
U.S. Food and Drug
Administration. Guidance for industry: E15 definitions for
genomic biomarkers, pharmacogenomics, pharmacogenetics,
genomic data and sample coding categories.
2008 (ingresado el 5 abril
2012)
http://www.fda.gov/downloads/RegulatoryInformation/Guidances/ucm129296.pdf
19.
Israel E, Drazen JM, Liggett SB, Boushey HA, Cherniack RM,
Chinchilli VM, et al. The effect of polymorphisms of the
beta2-adrenergic receptor on the response to regular use of
albuterol in asthma. Am J
Respir Crit Care Med
2000;162(1):75–80.
20.
Taylor DR, Drazen JM, Herbison GP, Yandava CN, Hancox RJ,
Town GI. Asthma exacerbations during long term beta agonist
use: influence of beta2 adrenoceptor polymorphism. Thorax
2000;55(9): 762–767.
21.
Israel E, Chinchilli VM, Ford
JG, Boushey HA, Cherniack R, Craig TJ, et al; Asthma
Clinical Research Network. Use of regularly scheduled
albuterol treatment in asthma: genotype-stratified,
randomised, placebo-controlled crossover trial. Lancet
2004;364(9444):1505–1512.
22.
USA FDA Information for
Healthcare Professionals - Fluticasone propionate;
Salmeterol xinafoate (marketed as Advair Diskus). 2005.
(Ingresado el 1 de abril 2012). Disponible en:
http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm162675.htm
23.
USA FDA. Information for
Healthcare Professionals - Formoterol fumarate.
2005.
(Ingresado el 1 de abril 2012). Disponible en:
http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm162677.htm
24.
US Food and Drug
Administration. Summary minutes of the joint
Pulmonary-Allergy Drugs Advisory Committee, Drug Safety and
Risk Management Advisory Committee, and Pediatric Advisory
Committee, December 10-11, 2008.
(Ingresado el 1 de abril 2012)
Disponible ent:
http://www.fda.gov/ohrms/dockets/AC/08/minutes/2008-4398m1-final.pdf.
25.
Beasley R, Perrin
K, Weatherall
M, Wijesinghe
M.
Call for withdrawal of LABA single-therapy inhaler in asthma.
Lancet. 2010
Sep 4;376(9743):750-1.
26.
Castle W, Fuller R, Hall J,
Palmer J.
Serevent nationwide
surveillance study: comparison of salmeterol with salbutamol
in asthmatic patients who require regular bronchodilator
treatment.
BMJ.
1993 Apr 17;306(6884):1034-7.
27.
Nelson HS, Weiss ST, Bleecker
ER, et al.
The Salmeterol Multicenter
Asthma Research Trial: a comparison of usual pharmacotherapy
for asthma or usual pharmacotherapy plus salmeterol.
Chest.
2006;129:15-26.
28.
Pauwels RA, Löfdahl
CG, Postma
DS, Tattersfield
AE, O'Byrne
P, Barnes
PJ, Ullman
A.
Effect of inhaled formoterol and budesonide on exacerbations
of asthma. Formoterol and Corticosteroids Establishing
Therapy (FACET) International Study Group.
N Engl J Med. 1997
Nov 13;337(20):1405-11.
29.
Salpeter SR, Buckley NS, Ormiston TM, Salpeter EE.
Long-acting beta-agonists increase severe asthma
exacerbations and asthma-related deaths: meta-analysis of
randomized controlled trials.
Ann Intern Med.
2006;144:904-912.
30.
Jaeschke R, O'Byrne
PM, Mejza
F, Nair
P, Lesniak
W, Brozek
J, Thabane
L, Cheng
J, Schünemann
HJ, Sears
MR, Guyatt
G.The
safety of long-acting beta-agonists among patients with
asthma using inhaled corticosteroids: systematic review and
metaanalysis.
Am J Respir Crit Care Med. 2008
Nov 15;178(10):1009-16.
Epub 2008 Sep 5.
31.
Bateman E, Nelson
H, Bousquet
J, Kral
K, Sutton
L, Ortega
H, Yancey
S.
Metaanalysis: effects of adding salmeterol to inhaled corticosteroids on serious asthma-relatedevents.
Ann Intern Med. 2008
Jul 1;149(1):33-42. Epub 2008 Jun 3.
32.
US Food and Drug Administration Office of Surveillance and
Epidemiology. Risks and benefits of long-acting beta
adrenergic agonists in the treatment of asthma. Available
at:
http://www.fda.gov/ohrms/dockets/ac/08/briefing/2008-4398b1-01-FDA.pdf.
33.
US Food and Drug Administration. Summary minutes of the
joint Pulmonary-Allergy Drugs Advisory Committee, Drug
Safety and Risk Management Advisory Committee, and Pediatric
Advisory Committee, December 10-11, 2008. Available at:
http://www.fda.gov/ohrms/dockets/AC/08/minutes/2008-4398m1-final.pdf
34.
Cates CJ, Cates MJ. Regular treatment with salmeterol for
chronic asthma: serious adverse events. Cochrane Database of
Systematic Reviews 2008, Issue 3. Art. No.: CD006363. DOI:
10.1002/14651858.CD006363.pub2.
35.
Cates CJ, Lasserson TJ, Jaeschke R. Regular treatment with
formoterol and inhaled steroids for chronic asthma: serious
adverse events. Cochrane Database of Systematic Reviews
2009, Issue 2. Art. No.: CD006924. DOI:
10.1002/14651858.CD006924.pub2.
36.
Sears MR, Ottosson A, Radner F,
Suissa S. Long-acting beta-agonists: a review of formoterol
safety data from asthma clinical trials.
Eur
Respir J.
2009;33:21-32.
37.
Rodrigo GJ, Moral
VP, Marcos
LG, Castro-Rodriguez
JA.
Safety of regular use of
long-acting beta agonists as monotherapy or added to inhaled
corticosteroids in asthma.
A systematic review.
Pulm
Pharmacol Ther. 2009
Feb;22(1):9-19. Epub 2008 Nov 5.
38.
Salpeter SR, Wall
AJ, Buckley
NS.
Long-acting beta-agonists with
and without inhaled corticosteroids and catastrophic asthma
events.
Am
J Med. 2010
Apr;123(4):322-8.e2. Epub 2010 Feb 20.
39.
McMahon AW, Levenson
MS, McEvoy
BW, Mosholder
AD, Murphy
D.
Age and
risks of FDA-approved long-acting β₂-adrenergic
receptor agonists.
Pediatrics. 2011
Nov;128(5):e1147-54. Epub 2011 Oct 24
40.
FDA. Long-Acting Beta-Agonists
(LABAs): New Safe Use Requirements.
04-15-2011Disponible
en:
http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm201003.htm
(ingresado el 1/5/2012)
41.
Orriols
R, Vallano A.
Riesgo de los
broncodilatadores agonistas β2-adrenérgicos de
acción prolongada en el asma bronquial. Med Clin (Barc).
2007; 128:352-4.
[Artículo].
42.
Perpiña
M. Controversia sobre los agonistas adrenérgicos ß2 de
acción prolongada en el asma. Medicina respiratoria 2008,(1)
1:21-31 (Ingresado el 25 setiembre 2011)
http://www.neumologiaysalud.es/descargas/R1/R1-3.pdf.
43.
Global Initiative for Asthma
(GINA). Asthma management and prevention. Updated 2011.
(ingresado EL 15 de abril
2012). Disponible en:
http://www.ginasthma.org/uploads/users/files/GINA_PocketGuide_2011.pdf
44.
British Thoracic
Society , Scottish Intercollegiate Guidelines Network.
British Guideline on
the Management of Asthma.
revised May 2011.
(ingresado EL 15 de abril 2012).
|