|
CASOS CLÍNICOS
Linfoma
plasmocitoide de intestino delgado. presentacion clinica con
un cuadro de abdomen agudo.
Kaplan R, Burgos
A, Rodriguez N, Meza Vetanzo Z, Ortiz S. Piccinni DJ.
Revista Facultad de Ciencias Médicas 2008; 65(3):
III Cátedra de
Patología. Servicio de Patología Hospital De Urgencias
Catamarca 446. Córdoba 5000. Argentina
Paturg3@yahoo.com.ar
Introducción
Los
tumores primarios de intestino delgado son raros (1). El
15-20% se corresponden con linfomas de tipo extranodal que
pueden derivar de las células B o T. La edad de mayor
incidencia oscila entre los 21 a 50 años siendo la relación
hombre mujer de 2:1 (2, 3-6). Clínicamente se presentan como
tumor, dolor, obstrucción abdominal, diarrea, sangrado o
peritonitis perforativa. (1-3, 5, 7,8)
Macroscópicamente, se encuentran formando una lesión
ulcerada extensa o úlceras múltiples (3). Microscópicamente
las células tumorales pueden infiltrar toda la pared
intestinal, acompañándose a veces de células multinucleadas
(3).
En las
formas de alto grado, la apariencia microscópica es la de un
linfoma de células grandes extremadamente pleomórfico, con
inmunoblastos y características plasmocitoides, mostrando
inmunopositividad para inmunoglobulinas de cadenas alfa.
(11-13)
Cabe
destacar que estos tumores son muy agresivos y de pronóstico
pobre (2,10).
Casos
clínicos
Paciente de 56 años con abdomen agudo debido a perforación
intestinal, que presentaba dolor de tipo cólico en fosa
ilíaca derecha y vómitos alimenticios. Tenía además
adenopatía cervical derecha, que ecográficamente se
correspondía con un proceso inflamatorio. Entre sus
antecedentes figuraba pérdida de peso de más de 6 meses
acompañada por un síndrome febril de 2 meses de evolución,
no habiendo otros síntomas previos a su presentación como
abdomen agudo.
Los
estudios de laboratorio arrojaron como únicos datos
significativos un valor de hemoglobina de 95,6 g/l y un
recuento de 12000 blancos con neutrofilia. La ecografía
abdominal confirmó la presencia de una perforación cercana
al apéndice cecal, por lo que se decidió una intervención
quirúrgica de emergencia. Durante la misma se detectó un
segmento perforado de íleon terminal que se resecó, sin la
presencia a simple vista de un tumor.
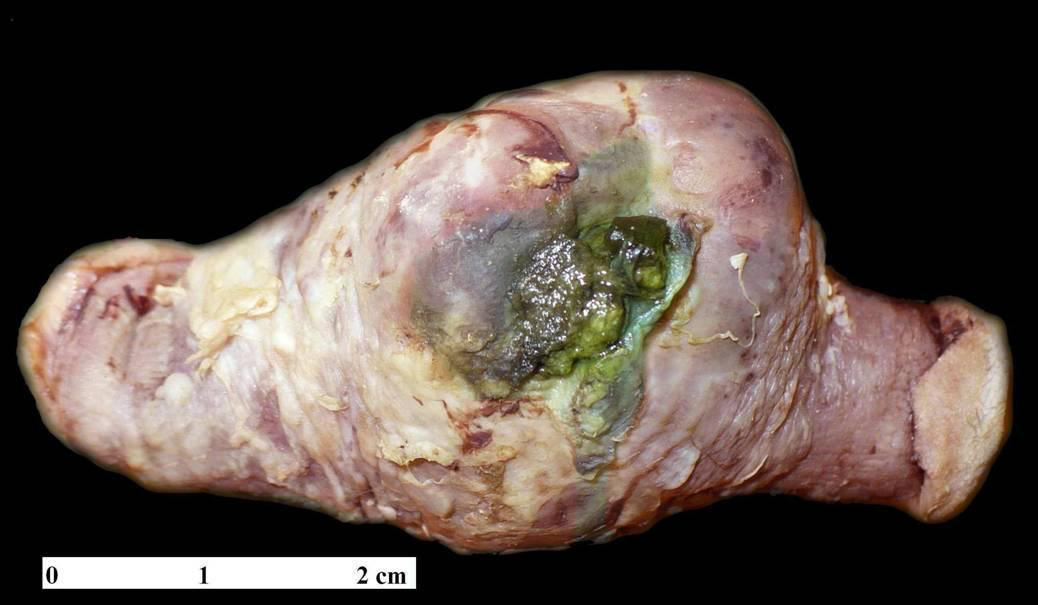
Se
recibió en el servicio de anatomía patológica un segmento de
intestino delgado de 9 cm de largo, cubierto por placas
blanco-amarillentas (Fig. 1).
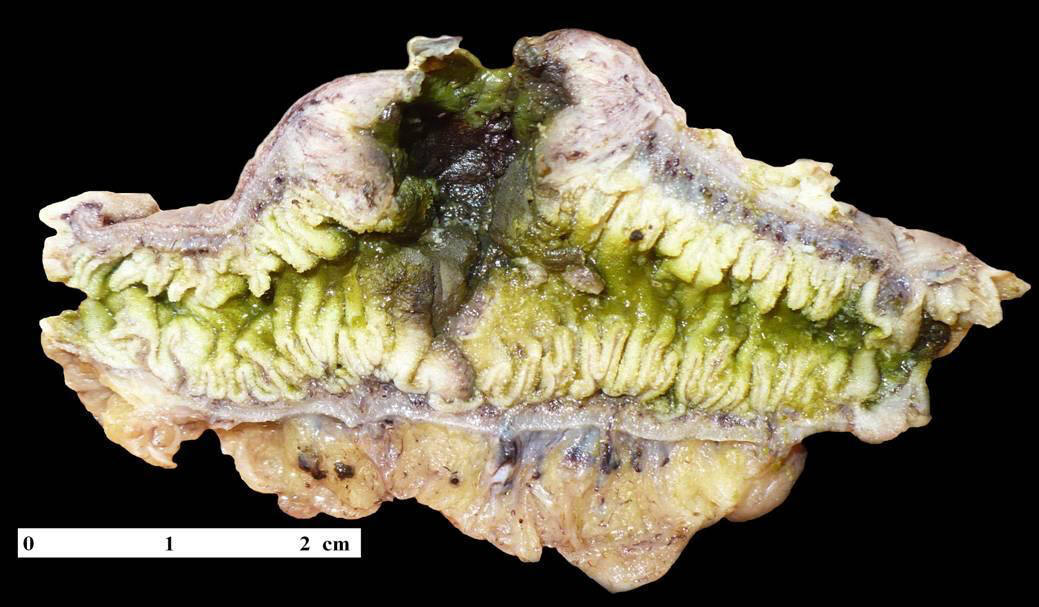
En su tercio medio, presentaba una perforación de 5mm de
diámetro (Fig. 2)
ubicada en el ápex de un área abultada (dilatada) de 4 cm de
diámetro. Al corte la pared que circundaba a la perforación
(en un radio de 15mm) se encontraba engrosada y gris
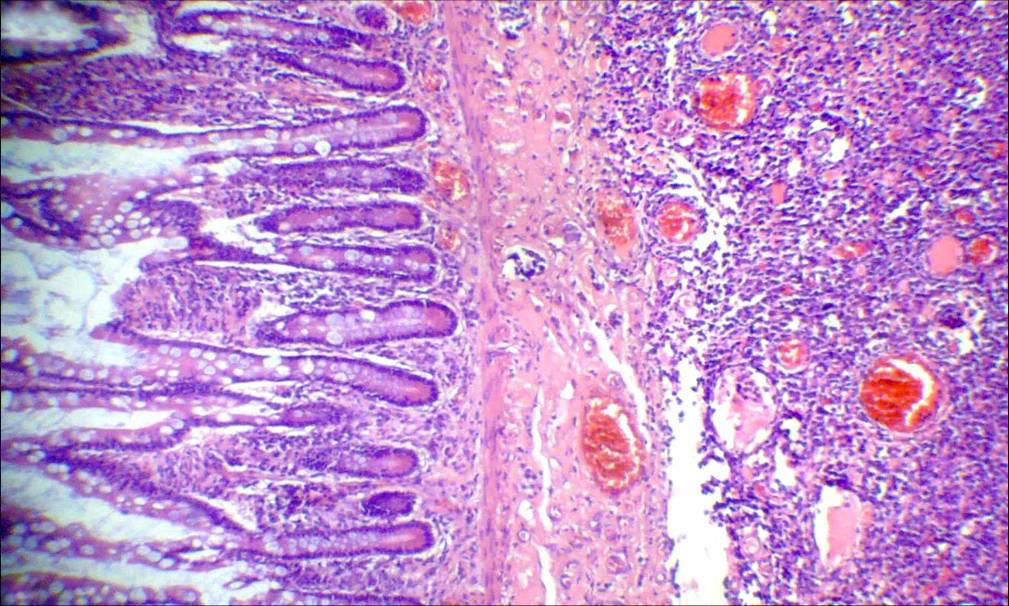
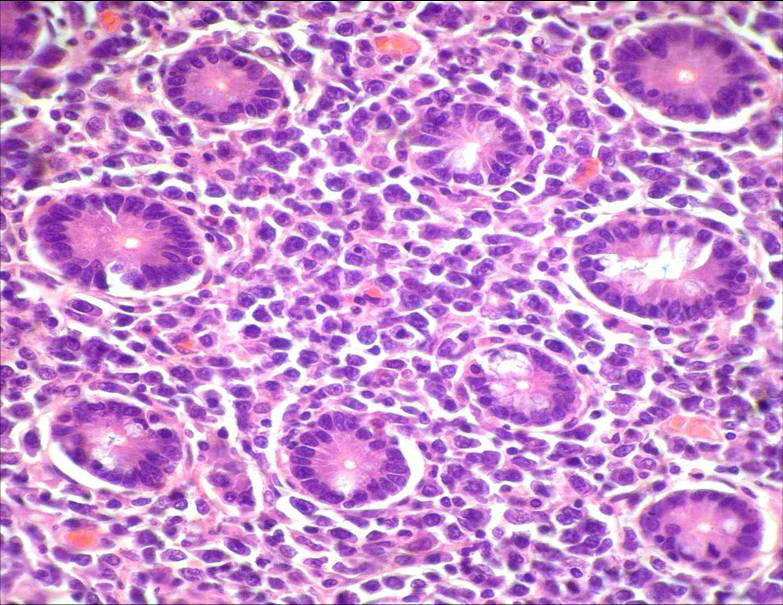
blanquecina, alcanzando 6mm de espesor. Microscópicamente,
en todo el espesor que circundaba a la perforación señalada,
se observaba una proliferación de células neoplásicas
grandes, dispuestas difusamente en amplias sábanas con
numerosos capilares sanguíneos dilatados (Figs.
3,
4 y
6), con núcleos vesiculosos y nucléolos conspicuos,
frecuentes mitosis y numerosos elementos de configuración
inmunoblástica y plasmocitoide (Fig.
5).
La
inmunomarcación arrojó positividad para inmunoglobulina de
cadena liviana Lambda, CD20, CD38 y CD3 (Figs.
7 a 10),
Conclusión anatomopatológica: neoplasia consistente con un
linfoma difuso de células grandes B, con marcada
diferenciación plasmocitoide, complicado con perforación y
peritonitis.
Discusión
Como ya
se señaló, los linfomas de intestino delgado
se presentan frecuentemente como tumor, dolor,
obstrucción intestinal, diarrea, sangrado o peritonitis
perforativa (1-3, 5, 7, 8). En este caso, el dolor de tipo
cólico ubicado en fosa ilíaca derecha y los vómitos fueron
los síntomas dominantes de presentación. La ecografía
confirmó la presencia de una perforación cercana al apéndice
cecal responsable del cuadro de abdomen agudo. Los vómitos
no se acompañaban de pérdida de sangre (tal como
hematemesis o enterorragia)no había alteraciones en la
motilidad como obstrucción o diarrea, ni así tampoco
enteropatía asociada, hallazgo este último común en los
linfomas T. La pérdida de peso de más de 6 meses estuvo
acompañada por un síndrome febril de 2 meses de evolución,
hechos que suelen presentarse en los síndromes
linfoproliferativos. La adenopatía cervical, que no se
biopsió y que podría ser parte de un síndrome
linfoproliferativo sistémico, fue ecográficamente
interpretada como un proceso inflamatorio. El bajo valor de
la hemoglobina es un hallazgo común en los síndromes
lifoproliferativos gastrointestinales.
No se
realizó, dado la emergencia, un tránsito intestinal, aunque
ante un cuadro de abdomen agudo son numerosos los
diagnósticos diferenciales que deben tenerse en cuenta
(perforación de úlcera péptica, vólvulo o invaginación
intestinal, peritonitis biliar, etc.)En este caso, el dolor
en fosa ilíaca derecha orientaba en principio a una
apendicitis aguda. Sin embargo, la ecografía permitió
confirmar la presencia de la perforación intestinal, que
llevó a una intervención quirúrgica de emergencia.
El
estudio macroscópico detectó la presencia de una perforación
de 5 mm en un área sobreelevada que microscópicamente estaba
constituida por una proliferación de células neoplásicas de
alto grado, con numerosos elementos de configuración
plasmocitoide. En relación con este ultimo punto, la
inmunomarcación permitió establecer el fenotipo real, es
decir, el de linfoma de células grandes B, con desarrollo
plasmocitoide.
La
modalidad de tratamiento con cirugía más quimioterapia y/o
radioterapia es la más comúnmente usada en los linfomas
gastrointestinales (14). En el caso que aquí presentamos se
combinó la cirugía con quimioterapia, no observándose
recidiva de la enfermedad en controles posteriores que se
realizaron del paciente.
Podemos
concluir que la presentación de este caso podría ser un
aporte interesante como puesta al día de linfoma intestinal
difuso de células grandes con marcada diferenciación
plasmocitoide, una lesión poco frecuente. Además, que debido
a la perforación intestinal se descubrió la enfermedad en
una etapa muy temprana (tumor muy pequeño que no se
evidenciaba en los estudios clínicos ni en la inspección
quirúrgica), lo que aumenta las oportunidades de sobrevida a
largo plazo del paciente.
Fig. Nº 1:
Segmento de intestino delgado, cubierto por
placas blanco-amarillentas.
Fig.
Nº2:
Segmento de intestino delgado que en su
tercio medio presenta una perforación de 5mm.
Fig.
Nº3:
Proliferación neoplásica dispuesta
difusamente con numerosos capilares dilatados. 100X
Fig.
Nº4:
Proliferación neoplásica con numerosos
capilares dilatados 400X
Fig.Nº5:
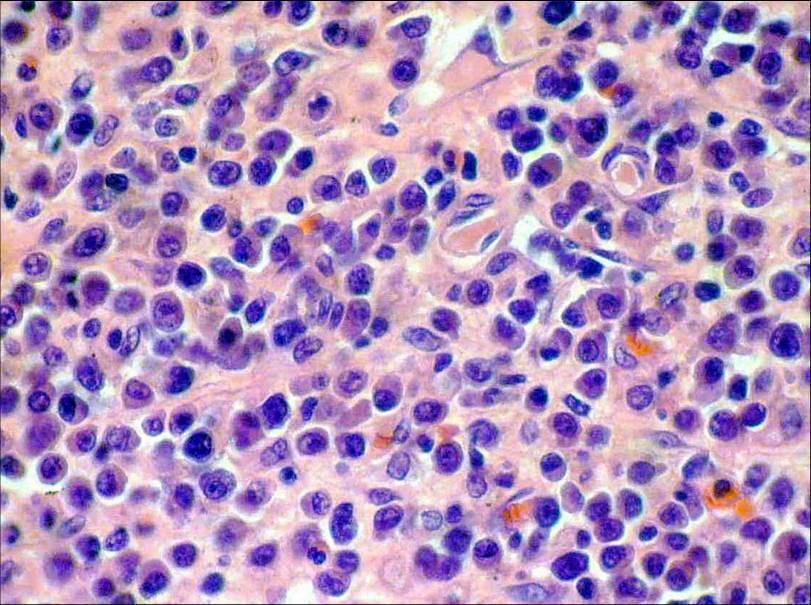
Céls. de núcleos vesiculosos de configuración
inmunoblástica y plasmocitoide. 400 x
Fig.
Nº 6:
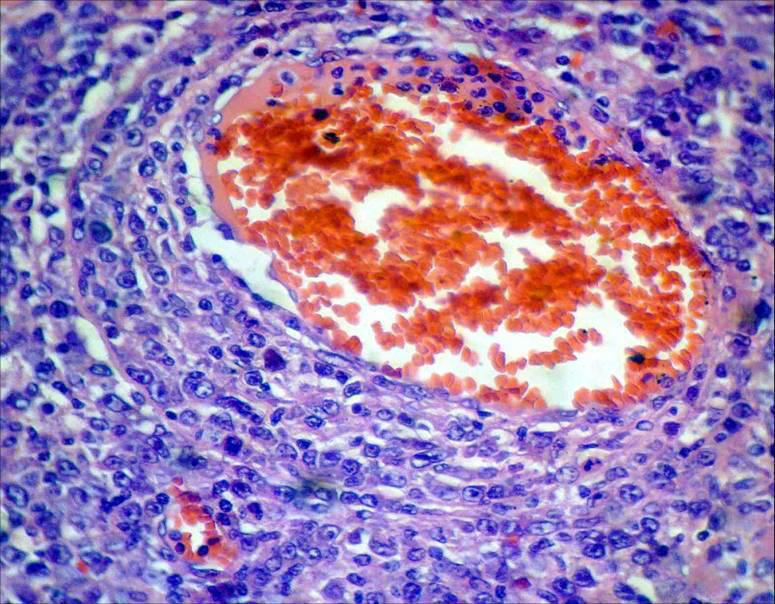
Proliferación de células neoplásicas de
disposición perivascular. 400X
Fig. Nº 7:
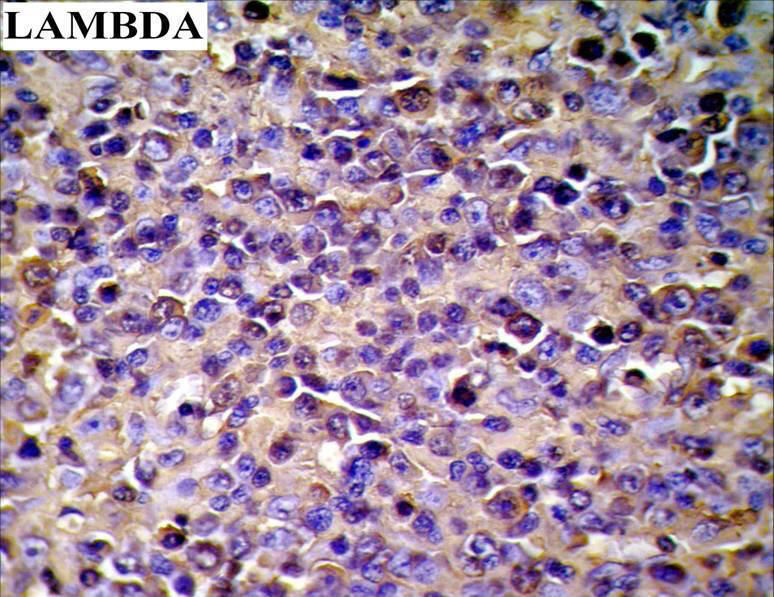
Inmunomarcación inmunoglubulina de cadena
liviana Lambda (+). 400X
Fig Nº 8:
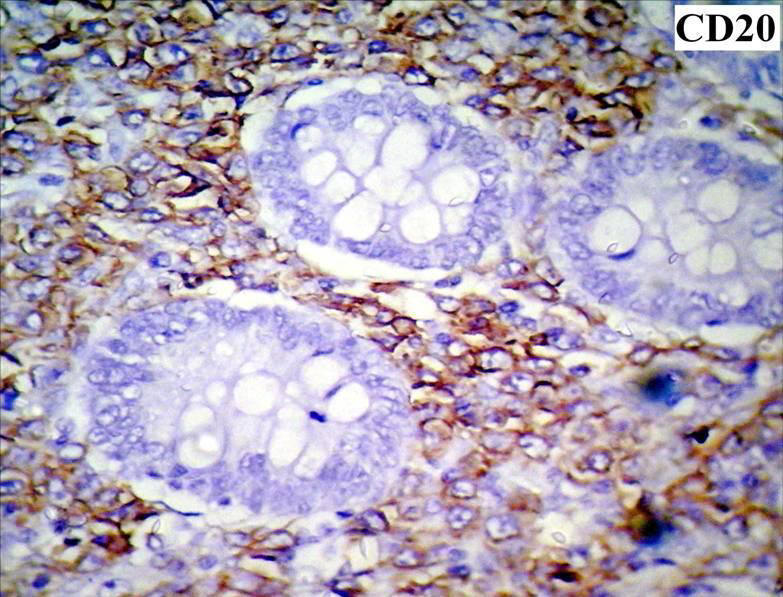
Inmunomarcación CD20 (+) que demuestra la
diferenciación de linfoma tipo B. 400X
Fig. Nº9:
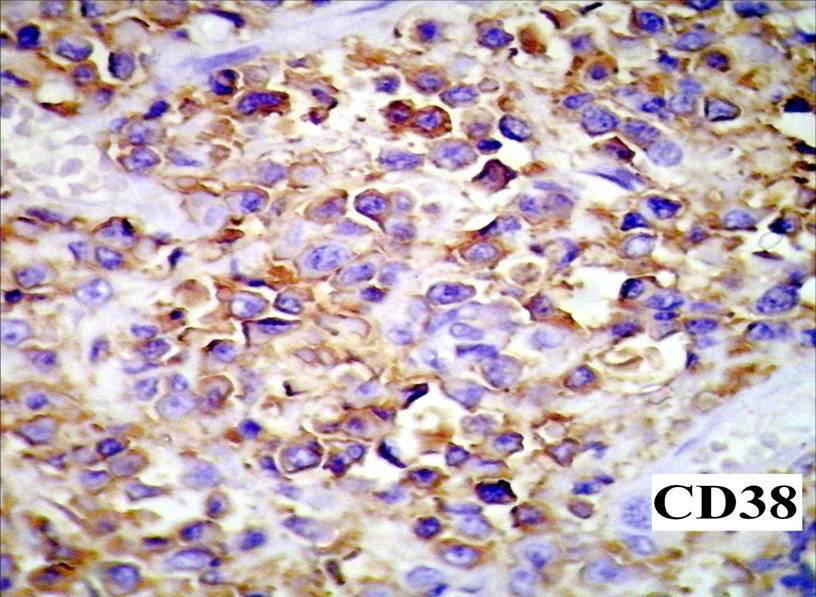
Inmunomarcación CD38 (+) que demuestra la
diferenciación plasmocitoide. 400X.
Fig Nº10:
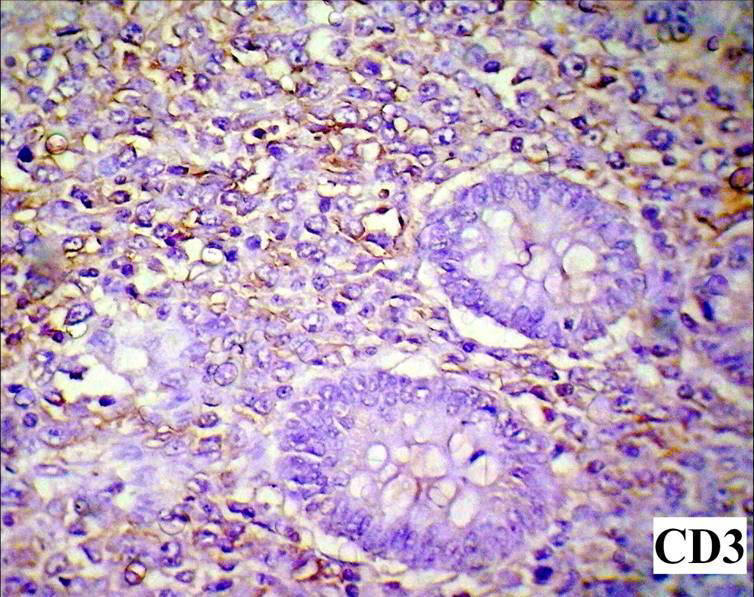
Inmunomarcación CD3 (+) que demuestra la
diferenciación de linfoma tipo B. 400X
Bibliografía
1-
Alzubi A, Zöllei I, Krenács L, Intzédy K, Hudák J. Primary
T-cell lymphoma of the small bowel. Magy Seb 2008;61:79-83.
[Abstract]
2- Molina Villaverde R, Jiménez Gordo A, López González Jl,
Redondo Sánchez A, Andreu Rodríguez M, González Barón M.
Primary intestinal T lymphoma: a report of two cases and a
review of the literature. A Med Interna 2002;199:457-9.
[Scielo Open Access]
3- Fakan F, Plank L, Szépe P, Boudová L, Feit V, Námĕstek
S. Intestinal T-cell lymphoma. Cesk Patol 2000;363:94-8.
4 - Hu RJ. Pathology and prognosis of 378 cases of primary
intestinal malignant lymphoma (IML).
Zhonghua Zhong Liu Za Zhi
1988;10:57-60. [Abstract]
5- Matsumoto K, Chikumi Y, Otani H, Hara A, Maeda K, Yasugi
A, Murawaki Y, Miura M, Koda M, Kawaguchi K, Harada K,
Yashima K, Tajima F, Murawaki Y, Horie Y. Two cases of
primary t cell lymphoma of the small intestine diagnosed by
perforated peritonitis. Nippon Shokakibyo Gakkai Zasshi
2007;104:388-93.[Abstract]
6- Sadamura S, Chihara T, Shibata K, Nishimura J, Nawata H,
Nakagaki M, Masuda Y, Ohshima K, Kikuchi M. Intestinal
T-cell lymphoma (so-called malignant histiocytosis of the
intestine) complicated by multiple perforations. Rinsho
Ketsueki 1991;321:34-8.[Abstract]
7- Kramer W, Richter HJ. Malignant lymphoma of the small
intestine as a cause of small intestine perforation.
Zentralbl Chir 1994;119:900-3.[Abstract]
8- Mechat F, Zerouali ON. Non-traumatic perforation of the
small intestine. J Chir (Paris). 1993;1306-7:292-6.
9- Yamamoto K, Shiraishi T, Ajiki T, Imai Y, Oyanagi H,
Saito Y. A case of intestinal T-cell lymphoma with repeated
episodes of perforation.
Gastroenterol JPN 1991;265:649-53.[Abstract]
10- Remacha B, Palau A, Velicia R, Caro-Patón A, Ripollés V.
Primary intestinal T lymphoma.
Rev Esp Enferm Dig 1998;903:183-90.[Abstract]
11- Haghighi P, Kharazmi A, Gerami C.
Primary upper small lymphoma and alpha-chain disease. Am J
Surg Pathol 1978;2:147-57. [Abstract]
12 - Nassar VH, Salem Pa, Shahid MJ.
Mediterranean abdominal lymphoma or immunoproliferative
small intestinal disease. Cancer 1978;41:1340-54.[Abstract]
13- Pangalis GA, Rappaport H. Common clonal origin of
lymphoplasmocytic proliferation and immunoblastic lymphoma
and intestinal alpha-chain disease. Lancet 1977;2:880.
14- Li B, Shi YK, He XH, Zou SM, Zhou SY, Dong M, Yang JL,
Liu P, Xue LY.
Primary non-Hodgkin lymphomas in the small and large
intestine: clinicopathological characteristics and
management of 40 patients. Int J Hematol 2008;87:375-81[Abstract]
 |