TRABAJO ORIGINAL
LESIONES PLACENTARIAS EN EMBARAZOS DE MADRE
ADOLESCENTE EN UNA MATERNIDAD PÚBLICA DE LA ARGENTINA
PLACENTAL
LESIONS IN TEENAGER`S PREGNANCIES OF A PUBLIC HOSPITAL OF
ARGENTINA
Cintia Hernandorena, Juan Sebastián García, Victoria Cavoti
Sadonio, Carlos
Grandi.
Revista Facultad de Ciencias
Medicas 2012; 69(1):7-14
Hospital
Materno Infantil Ramón Sardá, Unidad Anatomía Patológica,
División Obstetricia,
Epidemiología
Perinatal y Bioestadística. Luca 2151 (1259),
Buenos Aires, Argentina.
cgrandi@intramed.net
Financiación:
El presente trabajo de investigación fue
realizado con el apoyo de una Beca “Ramón Carrillo-Arturo
Oñativia”, categoría iniciación, otorgada por el Ministerio
de Salud de la Nación, a través de la Comisión Nacional
Salud Investiga, a la Dra Hernandorena.
Introducción
La Organización Mundial de la
Salud (OMS) define la adolescencia como “el período de la
vida en el cual el individuo adquiere la capacidad
reproductiva, transita los patrones psicológicos de la niñez
a la adultez y consolida la independencia socio económica”.
Además fija los límites de este período de la vida entre los
10 y los 19 años de edad.
En 2001 las adolescentes representaban el 18,3% de la
población total de la Argentina y el 29,1 % de la población
con necesidades básicas insatisfechas (1) En el Hospital
Materno Infantil Ramón Sardá, durante el año 2007, el 19 %
de los nacimientos correspondió a madres menores de 20 años.
(2)
De acuerdo a previos estudios3,4, las adolescentes
embarazadas menores de 17 años tendrían una mayor incidencia
de complicaciones relacionadas con el embarazo, así como una
mayor tasa de resultados perinatales adversos, mientras que
las adolescentes mayores de 16 años, se equipararían con la
población adulta joven (20- 29 años).
Existe fuerte evidencia de que la patología placentaria se
asocia con anormalidades funcionales durante la gestación.5
Tanto la morfología así como la histología son
importantes para identificar lesiones placentarias
descriptas en los estados de hipoxia crónica y de origen
infeccioso, asociadas con distintos eventos adversos
perinatales como bajo peso al nacer, prematurez e
hipertensión inducida por el embarazo6-8.
Nuestra hipótesis es que sería esperable encontrar una mayor
proporción de lesiones en placentas de madres adolescentes
en comparación con aquellas de madres adultas. El objetivo
del estudio fue describir el peso placentario y las lesiones
placentarias en madres adolescentes y estimar su riesgo en
comparación con madres adultas jóvenes.
Material y métodos
El presente estudio observacional se realizó en el Hospital
Materno Infantil Ramón Sardá de la Ciudad de Buenos Aires,
Argentina desde junio de 2009 hasta junio de 2010.
Se decidió dividir a la población adolescente en dos grupos:
menores o iguales a 16 años (jóvenes, younger teenage, n=18)
y de 17 años a 19 años (tardías, older teenage, n = 32). El
grupo de referencia incluyó aquellas puérperas entre 20 y 29
años (n=101) subsiguientes al caso. Se incluyeron
gestaciones de feto único nacido vivo, mayor de 22 semanas
de gestación o > 400 gramos de peso y se excluyeron la
hipertensión crónica y las anomalías congénitas y
cromosómicas.
La variable principal de resultado fue la presencia de las
siguientes lesiones placentarias9: Signos de hipoflujo
útero placentario (SHUP), hipermadurez vellositaria (HV),
cambios estructurales en los vasos maternos (VM, aterosis,
persistencia de la muscularización, necrosis fibrinoide),
hipoplasia distal de vellosidades (HVD), cordón umbilical
delgado (CUD), infartos placentarios (IP,<10% volumen
placentario/ >10% volumen placentario), corionitis y
corioamnionitis (respuesta inflamatoria materna, RIM)
(leve/moderada/severa), vasculitis coriónica, vasculitis
umbilical, funisitis (respuesta inflamatoria fetal, RIF)
(leve/moderada/severa)10. Para el análisis univariado y
multivariado se operacionalizó como la presencia de una o
más de las anteriores.
Las placentas fueron recolectadas en sala de partos y
fijadas en una solución de formaldehído al 10%. Luego fueron
pesadas sin cordón umbilical ni membranas y se calculó la
razón peso del recién nacido (PN, g) :peso placenta (PP, g).
Se procedió al examen macroscópico, tomándose muestras para
su posterior estudio histológico. El muestreo se realizó
según la técnica descripta por Benirshke11, que incluyen
dos tacos de cordón umbilical, un taco de membranas coriales
(rollo) y, al menos, cuatro tacos de parénquima y muestreo
adicional de lesiones macroscópicas. Se realizaron cortes
histológicos por inclusión de tejidos en parafina, los
cuales se colorearon con técnicas de hematoxilina – eosina.
Los profesionales a cargo del estudio histopatológico
desconocían la condición de caso o control, las variables
maternas y el resultado perinatal.
En sala de partos las candidatas fueron invitadas a
participar y, previo consentimiento informado, se
recolectaron datos sociodemográficos, obstétricos y
neonatales. Se definió Pequeño para la Edad Gestacional
(PEG) cuando el peso de nacimiento (PN) era menor al
percentilo 10 de la Curva local12.
Tamaño Muestral: Según la bibliografía y asumiendo que la
prevalencia de lesiones placentarias en la población general
es del 11% y en las madres adolescentes del 30%, con una
relación adolescente: adulta de 1:2, con un nivel de
confianza del 95% y una potencia del 80%, se calculó un
tamaño muestral de 150 (50 adolescentes).
Análisis estadístico
Se procedió a la descripción de las variables a partir de la
estimación de medidas de tendencia central (media, mediana o
proporciones según correspondiera) y medidas de dispersión
(desvío estándar, intervalo de confianza al 95% de la
proporción y rango intercuartílico). Se emplearon el Test de
Shapiro-Wilks o Lillefors para normalidad de la distribución
(Ho: distr.normal) y los test U de Mann-Withney, t de
Student y ANOVA para la comparación de variables continuas.
El riesgo bivariado (crudo) se calculó mediante el
estadístico Odds Ratio (OR) y su intervalo de confianza al
95%. El test de Chi2 con corrección de Yates o el test
exacto de Fischer, cuando correspondiera, se usó para la
comparación de variables categóricas.
Para analizar los riesgos de lesiones placentarias ajustados
por diferentes covariados potencialmente confusores se
desarrollaron dos modelos de regresión logística: a) Modelo
1, en que la variable de exposición era la edad de las
madres adolescentes (< 16 y 17 a 19 años) y el grupo de
referencia las adultas; b) Modelo 2, la variable de
exposición era la edad < 16 años y el grupo de referencia
las madres entre 17 y 24 años, bajo la hipótesis de que las
adolescentes tardías tienen un comportamiento similar a las
adultas. La bondad del ajuste (“calibración”) se estimó por
el estadístico de Hosmer-Lemeshow, mientras la capacidad de
discriminación se estimó por el área bajo la curva ROC.
Un valor p menor de 0.05 se consideró como indicador de
significación estadística. Todos los análisis se realizaron
utilizando el programa Stata 9.0 (Stata Corp, College
Station, TX).
El Comité de Ética de Investigación del Hospital Materno
Infantil Ramón Sardá aprobó el estudio el 24 de octubre de
2009.
Resultados
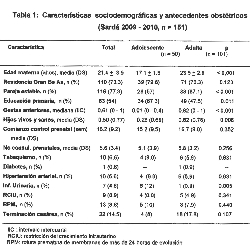
Como era esperable las madres adolescentes, en comparación
con las adultas, eran más jóvenes y presentaron menor
frecuencia de pareja estable, gestas previas e hijos vivos y
mayor educación primaria (p < 0,001). Además, mostraron
mayor prevalencia de patologías de la gestación, pero la
mitad de tasa de cesáreas (Tabla 1).
 |
Los recién nacidos (RN) hijos de madre adolescente
presentaron menor tasa de prematurez pero mayor prevalencia
de PEG en comparación con los de madres adultas, diferencias
estadísticamente no significativas (Tabla 2).
 |
No se encontraron diferencias entre los pesos placentarios
de los tres grupos (< 16 años = 488+ 100.5 g; 17-19 años =
500.1 + 94.0; 20 – 29 años = 497 + 91.5 g, p = 0.917) ni en
la razón PN: PP (6.62 + 1.20, 6.65 + 1.11 y 6.452 + 1.41
respectivamente, p = 0.704). Estos valores son ligeramente
superiores a los comunicados para similar media de EG (432
g)11
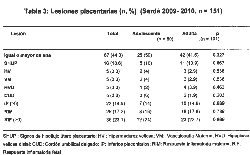
La mitad de las placentas tenían una o más lesiones con un
leve predominio en las de adolescentes (p = 0.327). Se
observó una elevada frecuencia de respuestas inflamatorias
materna y fetal (17.2 % [IC 95% 12 – 24] y 23.1% [17 – 30]
respectivamente), sin diferencias entre adolescentes y
adultas. Las placentas de adolescentes tuvieron mas lesiones
de HV, VM, CUD y RIF en comparación con las de adultas,
diferencias estadísticamente no significativas (Tabla 3).
 |
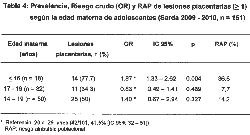
Al analizar la prevalencia de lesiones placentarias según la
edad de las adolescentes, en las < 16 años ascendieron al
77.78 % (14/18, IC 95% 54 – 91), mientras que entre 17 y 19
años fue del 34.3% (11/32, IC 95% 20 – 51), lo que significa
más del doble del riesgo en las de menor edad en comparación
con las mayores (OR 2.26, IC 95% 1. 32 – 3.38, p = 0.003).
El riesgo atribuible poblacional (RAP) fue de 14.2 % para
todas las adolescentes y de 36.6 % para las < 16 años,
imputables a la elevada prevalencia. (Tabla 4).
Comparando los dos grupos de edad de las adolescentes (< 16
y 17 a 19 años) con las adultas, los riesgos de lesiones
placentarias fueron 1.87 (IC 95% 1.33 – 2.62, p = 0.004) y
0.83 (IC 95% 0.49 – 1.41, p = 0.469), respectivamente. Esto
muestra que las adolescentes tardías no se diferenciaban de
las adultas (Tabla 4).
 |
En la tabla 5 se aprecia que el riesgo ajustado de presentar
lesiones en las placentas de madres adolescentes < 16 años
fue cuatro veces mayor en comparación con las adultas (p =
0.018), siendo el RAPa de 2.90 %. Esto se atribuye a mayor
proporción de lesiones HV (p = 0.624) y VM (p = 0.757) y una
similar proporción de lesiones IP (p = 0.624), RIF (p =
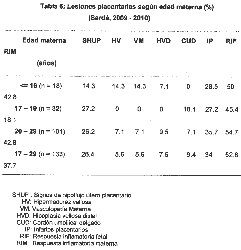
0.757) y RIM (p = 1) (Tabla 6). Las placentas de madres < 16
años mostraron, en comparación con las de 17 a 19 años,
mayor proporción de IP (p = 0.942), RIF (p= 0.821) y RIM (p
= 0.190), mientras que las placentas de madres entre 17 y 19
años mostraron una elevada proporción de lesiones SHUP, IP y
RIF, similar a lo observado en adultas en las que se
apreció, además, un 43% de lesiones RIM. Luego del ajuste el
riesgo de lesiones en madres entre 17 y 19 años disminuyó
levemente (0.81, p = 0.665, Tabla 5).
Tanto la bondad del ajuste como la capacidad de
discriminación fueron adecuadas. No se observó interacción
(estim
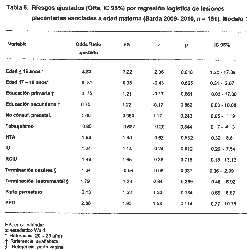 |
ada por el test z de Wald) entre HTA y RCIU (z = 1.66,
p = 0.097).
Con el propósito de aislar el efecto de la edad < 16 años
sobre las lesiones placentarias, los grupos 17 – 19 años y
20-24 años se colapsaron en una sola variable de referencia
(Modelo 2 de regresión logística, datos no presentados) y el
único cambio sustantivo que se apreció, respecto del Modelo
1 que incluía los dos grupos etarios de adolescentes, fue un
leve aumento del riesgo ajustado de lesiones en las
adolescentes < 16 años (ORa 5.10, IC 95% 1.40 - 18.54),
mientras que el RAP fue del 2.0%. Esto refuerza nuestra
hipótesis de que las adolescentes tardías tienen un
comportamiento similar a las adultas y sustentado por la
similitud en las proporciones de lesiones SHUP, IP y RIF
(Tabla 6). Nuevamente tanto la bondad del ajuste como la
capacidad de discriminación fueron adecuadas. Ambos modelos
explicaban cerca del 10 % (Pseudo R2) de las lesiones
placentarias.
 |
Discusión
Este estudio demuestra que la edad temprana de las
adolescentes (< 16 años) se asocia independientemente con
importantes lesiones placentarias.
Las características sociodemográficas de las adolescentes
fueron las típicas de esta edad. De destacar es que se
observó, para las adolescentes, un considerable aumento del
riesgo ajustado de HTA, RCIU, parto prematuro y PEG asociado
a lesiones placentarias (tabla 5), en concordancia con
estudios anteriores (13).
La placenta se desarrolla tempranamente durante la vida
intrauterina y su rápido crecimiento en el primer trimestre
es importante para la transferencia de nutrientes necesarios
para asegurar un adecuado crecimiento fetal.14-16
El peso placentario es una manera de estimar el crecimiento
placentario. La placenta, en gran medida, traduce cómo el
feto experimenta el ambiente materno y, además de
influencias genéticas, se considera la principal influencia
sobre el PN.16,17 Se observó que al final de la
gestación el volumen placentario de ovejas jóvenes en
crecimiento se reducía un 45% (vs controles) y el feto
mostraba restricción asimétrica asociada a importantes
reducciones en el flujo sanguíneo uterino y umbilical, con
consiguiente reducción del transporte de oxígeno, glucosa y
aminoácidos.18 Esto contrasta con los hallazgos del
estudio en que las placentas de adolescentes presentaron
mayor proporción de peso mayor al percentilo 90 en
comparación con las adultas (8.16 % vs 5.3%, p = 0.376) (19)
atribuibles al edema que acompaña a las respuestas
inflamatorias materna y fetal.
Los hijos de madres adolescentes mostraron una leve
disminución del PN y mayor proporción de PEG. Esto concuerda
con otros estudios que mostraron que las madres entre 12 y
16 años presentaron mayor riesgo de RN < 2500 g que las
adolescentes tardías o adultas.14,15 Tanto el bajo peso
al nacer como la restricción del crecimiento intrauterino se
asocian a lesiones placentarias por hipoxia crónica como
SHUP, VM e HV, observadas en nuestra población adolescente
con mayor frecuencia que en las madres adultas.20
Las lesiones de los vasos maternos y en el sitio de
implantación se hallan comúnmente asociadas a parto
pretérmino y restricción del crecimiento intrauterino
(RCIU). Esto se debería, entre otras razones, a la
liberación de factor soluble de crecimiento vascular
endotelial tipo 1 (SVEGF- 1) a partir del trofoblasto en
respuesta a la isquemia21. Por otro lado Redmer y col.
hallaron que el embarazo en ovejas jóvenes tiene un impacto
negativo en el factor angiogénico/expresión del receptor
placentarios que explicaría el bajo peso al nacer de la
prole.22
Esto coincide con que la frecuencia de CUD fue 3 veces mayor
en adolescentes (tabla 3) atribuible en parte a disminución
del contenido de la gelatina de Wharton, especialmente en
PEG.
Fue notable la elevada frecuencia de lesiones placentarias
observadas en esta muestra, en especial IP, RIM y RIF,
aunque sin diferencias entre casos y controles y en analogía
con un estudio anterior23. Los infartos placentarios en
la muestra estudiada fueron lesiones pequeñas que
comprometían menos del 10% del volumen placentario, por lo
cual no tendrían implicancia clínica24. La similitud en
la incidencia de lesiones asociadas a infección ovular, y
sus correspondientes expresiones histopatológicas (RIM y
RIF) en ambos grupos estudiados, se correlaciona con la tasa
de prematurez similar en ambos grupos, ya que la infección
ovular ha sido descripta como una de las causas más
frecuentes de parto pretérmino25 y ruptura prematura de
membranas26,27.
Al estratificar por edad a las adolescentes se confirmó
nuestra suposición de que, desde el punto de vista
histopatológico, las mujeres entre 17 y 19 años se comportan
como adultas jóvenes; esto se vio reflejado en que el riesgo
de estas mujeres no difirió estadísticamente de las adultas
(Tabla 4).
Fue notable el hallazgo de que las madres < 16 años
presentaron entre el doble y cinco veces más probabilidad de
lesiones placentarias en comparación con las de 17 a 19 años
o entre 17 y 24 años, según el análisis (Tablas 4 y 5). Los
mecanismos biológicos que subyacen detrás de esta asociación
son tanto controversiales como especulativos.
Al comparar las lesiones placentarias discriminadas por tipo
de lesión y edad (tabla 6), se pudo observar que las
lesiones por hipoflujo útero placentario (SHUP) se
encontraron con más frecuencia en las placentas de mujeres
adultas. Este tipo de lesión se debe a fallas en la
irrigación de la placenta a nivel de las arterias uterinas,
y se expresa en el doppler de arterias uterinas alterado,
por lo que es esperable encontrarla en mujeres de mayor
edad, ya que tienen más predisposición a tener este tipo de
vasculopatía asociada a la edad, mientras que la
vasculopatía decidual (VM) es más frecuente en las
adolescentes. Otra lesión asociada a hipoxia crónica como
hipermadurez vellositaria (HV), cuya expresión clínica
serían la RCIU y PEG, fueron más del doble en las placentas
de madre adolescentes (Tabla 6).28 Creemos que las
diferencias estructurales halladas reflejarían un mecanismo
compensatorio de madres ginecológicamente menos maduras
sobre el desarrollo y función placentaria, facilitando el
intercambio de gases y nutrientes para salvaguardar el
crecimiento fetal y coincide con una mayor proporción de
peso superior al percentilo 90 en las placentas de
adolescentes.
Estos hallazgos, en el caso de ser reproducidos en otras
poblaciones y con mayor muestra, plantean la pregunta sobre
los efectos a largo plazo sobre los niños. Ya se ha
documentado la asociación entre lesiones placentarias
específicas y trastornos en el crecimiento temprano de
prematuros extremos27 Además, existe la posibilidad de
que estas lesiones, la mayoría asociadas a elevada
frecuencia de resultados perinatales adversos, conlleve el
riesgo de enfermedades crónicas no transmisibles en la edad
adulta (Hipótesis de Barker).29
Desde el punto de vista poblacional el riesgo atribuible de
las madres < 16 años superó el 30% y el 14 % para todas las
adolescentes; esto implica que en el caso de poder reducirse
el embarazo de esta faja etárea significaría una importante
reducción de las lesiones placentarias. Sin embargo al
ajustarlo por diferentes covariados el RAP cayó al 2%, lo
que sugiere otros factores no estudiados en la relación
entre edad temprana y lesiones placentarias.
Ventajas y limitaciones
De nuestro conocimiento este es el primer estudio en nuestro
país y la región que explora la potencial relación entre la
edad materna temprana y lesiones placentarias examinadas por
profesionales sumamente entrenados. Es posible que el
muestreo por conveniencia así como los amplios intervalos de
confianza pueda crear cierta incertidumbre sobre el
verdadero valor. La prevalencia de las lesiones fueron
relativamente elevadas y el odds ratio podría no ser una
buena aproximación al riesgo relativo y, además , por ser la
Sarda un centro de derivación, los controles pueden no ser
representativos de una población general en términos de
exposición. Por dichas razones los riesgos atribuibles
calculados podrían presentar sesgos.
Las conclusiones de este estudio deben ser tomadas con
precaución, ya que se trata de un estudio de base
hospitalario, por lo que las generalización a la población
general debería tomarse con prudencia.
Conclusiones
Este estudio demuestra que la edad temprana de las
adolescentes (< 16 años) se asocia independientemente con
importantes lesiones placentarias por lo que deberían
focalizarse acciones no sólo para disminuir las tasas de
embarazo en esta población sino que, además, deberían
recibir una atención perinatal enfocada a detectar
precozmente y prevenir estas lesiones.
Bibliografía
1. Vuegen S. Salud de la población adolescente en
Argentina. Arch argent pediatr 2003; 101(6): 491 – 494.Full
Text
2. Laterra C, Luchtenberg G, Grandi C, Pensotti A.
Estadísticas 2007 del Hospital Materno Infantil “Ramón
Sardá”. Rev Hosp Mat Inf Ramón Sardá 2008; 27(4): 162-165.
3. Satin AJ, Leveno KJ. Maternal youth and pregnancy
outcome: middle school versus high school age groups
compared with women beyond the teen years. Am J Obstet Gynec
1994; 171: 184- 187.
PubMed
4. Conde Agudelo A, Belizán J, Lammers C. Maternal perinatal
morbidity and mortality associated with adolescent pregnancy
in Latin America. Am J Obst Gynecol 2005; 192: 342 – 349.
Full Text
5. Fox H: Pathology of the placenta. W B Saunders,
Philadelphia, 1978.
6. Roberts DJ. The placenta in pre-eclampsia and
intrauterine growth restriction. J Clin Pathol 2008; 61:
1254- 1260.
PubMed
7. Mestan K. Placental Inflammatory response is associated
with poor neonatal growth: Preterm Birth Cohort Study.
Pediatrics 2010; 125(4): 891- 898.
Full text
8. Ahmet A, Hecher K. Fetal Growth Restriction due placental
disease. Seminars in Perinatology 2004; 28 (1): 67- 80.
PubMed
9. Faye- Peterson OM. The placenta in preterm bith. J Clin
Pathol 2008; 61: 1261 – 1275.
PubMed
10. Redline R. Inflammatory response in the placenta and
umbilical cord. Seminars in Fetal & Neonatal Medicine 2006;
11: 296-301.
PubMed
11. Benirschke K, Kaufmann P: Pathology of the human
placenta. Springer – Verlag, New York. 2000, 2 nd. ed.
12. San Pedro M, Grandi C, Larguía M, Solana C. Estándar de
Peso para la Edad Gestacional en 55706 recién nacidos sanos
de una Maternidad pública de Buenos Aires. Medicina (Buenos
Aires) 2001; 61:15-22.
Full Text
13. Perry R, Mannino B, Hediger M, Scholl T. Pregnancy in
early adolescence: Are there obstetric risks? Journal of
Maternal-Fetal and Neonatal Medicine 1996; 5: 333-339.
PubMed
14. Usta U, Zoorob D, Abu-Musa A, Naassan G, Nassar A.
Obstetric outcome of teenage pregnancies compared with adult
pregnancies. Acta Obstetricia et Gynecologica Scandinavica
2008; 87: 178-183.
PubMed
15. Wallace J, Luther J, Milne J, Aitken R, Redmerb D.
Nutritional Modulation of Adolescent Pregnancy Outcome – A
Review. Placenta 2006; 27 (Supp. A): S61-S68.
PubMed
16. Thame M, Osmond C, Bennett F, Wilks R, Forrester T.
Fetal growth is directly related to maternal anthropometry
and placental volume. Eur J Clin Nutr 2004; 58: 894–900.
PubMed
17. Salafia C, Zhang J, Charles A, Bresnahan M, Shrout P,
Wenyu Sun and Elizabeth M. Maas. Placental characteristics
and birthweight. Paediatric and Perinatal Epidemiology 2008;
22: 229–239).
PubMed
18. Wallace J, Aitken R, Milne J, Hay W. Nutritionally
mediated placental growth gestriction in the growing
adolescent: Consequences for the fetus. Biol Reprod 2004;71:
1055–1062
Full Text
19. Boyd JD, Hamilton WJ: General description of specimens:
statistics of placental growth. En: Boyd JD, Hamilton WJ:
The Human Placenta. W Heffer and Sons Ltd. Cambridge. 1970,
p. 112.
20. Paiva de Alvarez S, Guevara J, Guevara B, Nuccio C,
Kizer S. Análisis de la placenta en el retardo del
crecimiento intrauterino. Obstet ginecol latinoam 1986;
44:179-86.
21. Maynard S, Min J, Merchan J, Lim K, Li J, Mondal S et
al. Excess placental soluble fms- like tirosine kinase 1
(sFlt1) may contribute to endothelial dysfunction,
hypertension and proteinuria in preeclampsia. J Clin Invest
2003; 111: 649- 658.
Full Text
22 Redmer D, Aitken R , Milne J , Reynolds L Wallace J .
Influence of Maternal Nutrition on Messenger RNA Expression
of Placental Angiogenic Factors and Their Receptors at
Midgestation in Adolescent Sheep. Biol Reprod 2005; 72:
1004-1009.
Full Text
23. Stevens-Simon C, Metlay L, Pruksananonda C, Maude J,
McAnarney E. Placental histomorphometry in adolescent
pregnancy. J Matern Fetal Med 1993; 2: 294-299.
24. Krauss F; Redline R. Atlas of non tumor pathology:
Placental pathology. Armed Forces Institute of Pathology.
Washington DC, 2004.
25. Goldenberg RL, Culhane JF, Iams JD, Romero R.
Epidemiology and causes of preterm birth. Lancet 2008; 371:
75–84
PubMed
26. Faye- Peterson OM. The placenta in preterm birth. J Clin
Pathol 2008; 61: 1261 – 1275.
27. Mestan K, Yu Y, Matoba N, Cerda S, Demmin B, Pearson C
et al. Placental inflammatory response is associated with
poor neonatal growth: Preterm Bith Cohort Study. Pediatrics
2010; 125: e891- e898.
Full Text
28. Baschat A. Fetal Growth Restriction due to Placental
Disease. Seminars in Perinatology 2004; 28 (1): 67 – 80.
PubMed
29. Barker DJP, Osmond C, Golding J, Kuh D, Wadsworth MEJ.
Growth in utero, blood pressure in childhood and adult life,
and mortality from cardiovascular disease. BMJ 1989; 298:
564 – 567.
Full Text
|