|
TRABAJO DE CASUÍSTICA Y CASOS
CLÍNICOS
NEUMONÍA EOSINOFÍLICA
CRÓNICA. INFORME DE CASO.
CHRONIC
EOSINOPHILIC PNEUMONIA
Florencia Vivero1, Cleto Ciocchini1, María J. Gandini1,
Luis Wehbe2
Revista Facultad de Ciencias
Medicas 2012; 69(1):42-46
1-Servicio de Clínica Médica,
2-Servicio de Neumonología, Hospital Privado de Comunidad,
Mar del Plata.
Direción postal: Florencia Vivero, Hospital Privado de
Comunidad, Córdoba 4545, Mar del Plata.
Fax: (0223) 4990099 – Tel: (0223) 4990000 e-mail:
florencia_vivero@hotmail.com
Introducción
La neumonía eosinofílica crónica (NEC) forma parte de
las eosinofilias pulmonares (EP), término que incluye un
grupo de patologías caracterizadas por infiltrados
pulmonares con eosinofilia periférica y/o alveolar. Son
entidades heterogéneas en cuanto a su etiología, pero
similares en el mecanismo por el cual producen inflamación y
lesión del parénquima pulmonar. En ellas, el eosinófilo es
la célula protagonista, siendo el mediador de una respuesta
inmunológica de hipersensibilidad ante diversos estímulos.
La primera descripción de casos de tos y fiebre con
infiltrados radiológicos y eosinofilia la realizó Löeffler
en 1936. Luego Reeder y Goodrich sugieren el término
síndrome PIE1. Más tarde Carrington2-3 publica una serie de
casos proponiendo el término neumonías eosinofílicas,
describe la NEC y define los criterios diagnósticos que
llevan su nombre (Tabla 1).
|
CRITERIOS
DIAGNÓSTICOS DE CARRINGTON |
|
Inicio subagudo |
|
Hipoxemia leve |
|
Infiltrados
difusos periféricos |
|
Eosinofilia en
BAL y sangre |
|
Ausencia de
infecciones por parásitos u hongos |
|
Ausencia de
fármacos |
|
Respuesta
completa y precoz a corticoides |
|
Recidiva
frecuente al suprimir esteroides |
|
Caso clínico
Hombre de 33 años, con antecedentes de asma de 2 años de
evolución, bajo tratamiento con salmeterol y fluticasona, e
hipertrofia de la mucosa de los senos paranasales por TC.
Consultó por tos seca, irritativa, crónica, de un año de
evolución, a la cual se había sumado, dos semanas atrás,
fiebre > 38ºC de predominio nocturno, sudoración profusa,
mialgias generalizadas y pérdida de peso de 3 kg en un mes.
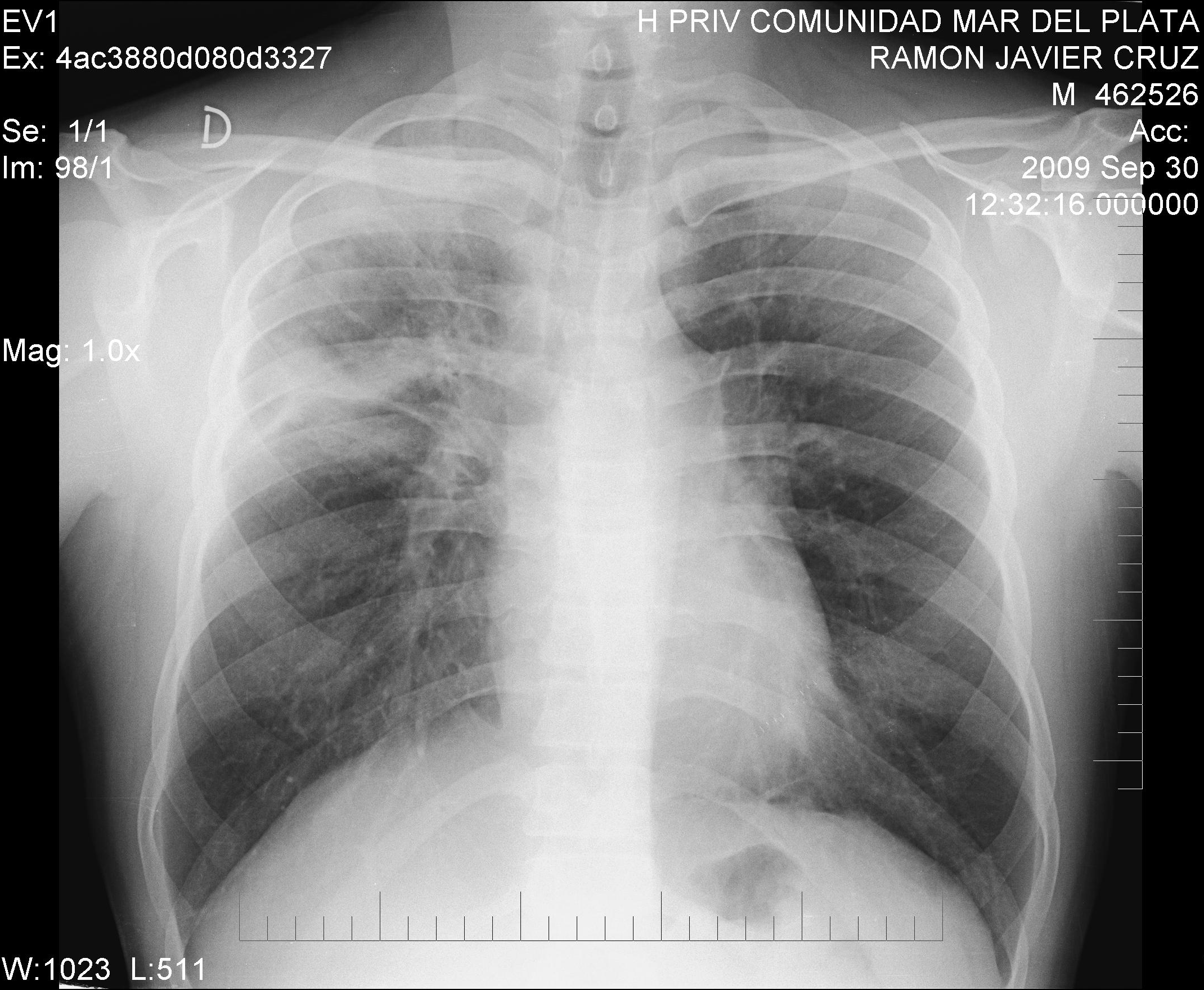
Se le realizó una radiografia (Rx) de tórax frente (Fig.1)
visualizándose un infiltrado de bordes mal definidos en
vértice y campo medio derecho. Se indicó tratamiento
ambulatorio con claritromicina 500 mg cada 12 horas.
Luego de 14 días de tratamiento persisten los síntomas, por
lo cual, ingresa al servicio de clínica. Al examen se lo
halla taquipneico, con estertores crepitantes biapicales.
Estaba afebril y normotenso, la frecuencia cardiaca 85
latidos por minuto. Sat HbO2: 96% a aire ambiente. El
laboratorio de ingreso mostró: leucocitosis de 18.400/mm³ y
eritrosedimentación 80 mm. Hematocrito, recuento de
plaquetas, función renal, ionograma, glucemia y hepatograma
normales. Serología para HIV (-). Un electrocardiograma
normal. Una nueva Rx de tórax mostró un infiltrado de
características similares.
El oficio del paciente era carnicero, no era etilista ni
tabaquista. No había viajado recientemente. Negaba factores
de riesgo para ETS. No tenía contacto epidemiológico para
TBC.
Se solicitó una TC de tórax sin contraste que mostró; áreas
de consolidación intersticioalveolar, parcheadas, en ambos
hemitórax, predominante en regiones periféricas y
posteriores. Estas imágenes, llamativamente, no eran
concordantes con la Rx simple, en la que sólo era visible un
infiltrado en hemitórax derecho.
El caso se redefinió como una neumonia multifocal, de
etiología, hasta el momento, desconocida. Se decide realizar
una broncofibroscopía (BFC) con el objetivo de obtener una
muestra de parénquima, pero el paciente se negó a dicho
procedimiento.
Ante esta situación, el servicio de infectología indica
iniciar tratamiento empírico para tuberculosis con cuatro
drogas. No fue posible obtener esputo para baciloscopía,
dado que el paciente no presentaba expectoración. Se realizó
una prueba tuberculínica cutánea (PPD).
El paciente no presentó fiebre durante la internación y
permanecía en buen estado general, por lo que, a los tres
días del ingreso, se le da el alta hospitalaria, con
seguimiento ambulatorio.
En el control, a la semana, refería persistencia de los
síntomas. Se le solicita un hemograma que evidenció
leucocitosis de 18.730/mm³ con la siguiente fórmula:
segmentados 41%, linfocitos 17%, eosinófilos 34% (valor
absoluto: 6370/mm³). La lectura de la PPD fue informada de 0
mm.
Una semana luego, a 15 días del alta, reingresa por
persistencia de la fiebre, la sudoración y la tos, sin
cambios en sus características, agregando marcada astenia y
disnea de esfuerzo progresiva. Se hallaba taquicárdico,
febril, taquipneico con buena entrada bilateral de aire sin
ruidos agregados. Se tomaron hemocultivos. Un nuevo
laboratorio informa VES 69 mm y 22.120/mm³ leucocitos con
31% de eosinófilos, siendo 6800 el valor absoluto. Se
solicitó una nueva Rx de tórax (Fig. 2) que evidenció nuevo
infiltrado en campo medio izquierdo con resolución del
infiltrado previo.
Se realizó una gasometría arterial a aire ambiente: PH 7.46
/ PCO2: 30 mmHg / PaO2: 101 mmHg / EB -0.4 / HCO3ˉ: 21 meq/l
/ SatHbO2 97%, con un gradiente alvéolo-arterial de O2
calculado: 11.5 mmHg.
Se solicitaron exámenes complementarios en busca de causas
de EP; IgE: 183.2 UI/ml (VN: 180 UI/ml), Coproparasitológico
(-), ANCA (-), FAN (-), Orina completa normal. TAC de
abdomen normal.
Se plantea nuevamente realizar una BFC y el paciente accede.
El LBA informó abundantes macrófagos alveolares y
eosinófilos correspondiendo éstos a más del 50% de los
leucocitos presentes. El esputo pos LBA mostró 40% de
eosinófilos y abundantes cristales de Charcott-Leyden. No se
observaron inclusiones virales ni células atípicas. Directo
y cultivo para BAAR (-).
El cuadro cumplía criterios para NEC 2 (tabla 1) y, ante la
ausencia de evidencia infecciosa y respuesta a los
antimicrobianos, se interrumpió el tratamiento
antituberculoso y se inició Prednisona 60 mg diarios. A las
48 hs mejoró la disnea y la astenia. La fiebre y la
sudoración mejoraron lentamente. La tos redujo su
intensidad, pero no desapareció, persistiendo hasta dos
meses luego del inicio de la corticoterapia.
Al mes presentaba 548 mm³ eosinófilos, VES 1mm, Ig E: 133.8
UI/ml y resolución del infiltrado radiológico. En los
controles posteriores las radiografías fueron normales. El
recuento de eosinófilos oscila entre 400 y 500 /mm³. La
espirometría realizada a los 4 meses fue normal. Se realizó
un descenso paulatino de los esteroides estando actualmente,
tras 6 meses de tratamiento, con 10 mg de Prednisona sin
recurrencia de los síntomas.
|
 |
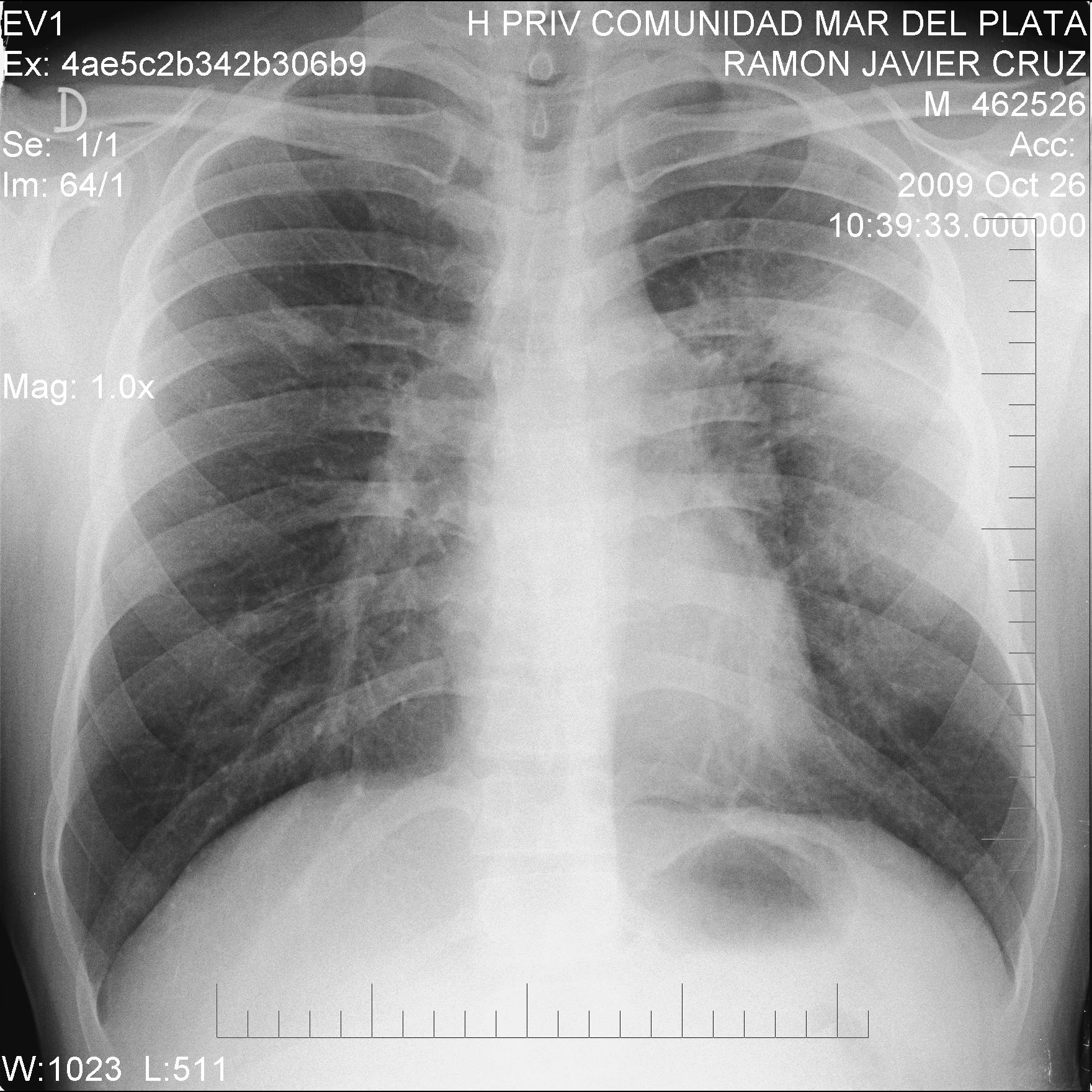 |
FIGURA 1.- Rx de tórax: opacidad de bordes difusos
en vértice
y campo medio derecho. |
FIGURA 2.- Rx de
tórax: migración del infiltrado.
Discusión |
Existe más de una clasificación para las EP. La
clasificación etiológica las divide de acuerdo al hallazgo
de una causa definida o no. La clasificación de Allen4-5
(tabla 2) posee un enfoque fisiopatológico y propone dos
grupos de entidades; aquellas en las que el eosinófilo es la
célula fundamental de la inflamación, y otras que cursan con
eosinofilia sólo en forma casual. Enfatiza en si realmente
el daño pulmonar es ocasionado por una inflamación
eosinofílica, y esto es lo que se expresa en sangre
periférica, o si hay coexistencia de patología pulmonar y
eosinofilia pero sin relación causal entre ambas, siendo una
coincidencia su presencia simultánea. Ejemplos de ésta
situación: asma o atopía, la reacción alérgica a un fármaco
o droga (cocaína), patologías oncohematológicas; donde hay
hiperproducción autónoma de eosinófilos y un estado de
inmunodepresión que predispone a neumonías bacterianas.
En las “verdaderas” EP, los eosinófilos activados por
alergenos de hongos, antígenos parasitarios u otro
mecanismo, proliferan en la médula ósea, pasan a la
circulación periférica e infiltran el parénquima pulmonar.
En estos cambios intervienen las citoquinas IL3, IL5, factor
activador de plaquetas (PAF) e IFN-γ. Los eosinófilos
liberan diversas enzimas que ocasionan daño tisular,
destacándose la proteína básica mayor, peroxidasa,
lipofosfolipasa (que característicamente forma los cristales
de Charcott Leyden), leucotrienos. Si bien, es la célula de
mayor rol patogénico, hay activación de linfocitos,
plasmocitos, macrófagos y neutrófilos6.
Con respecto al recuento de eosinófilos en sangre periférica
interesa el valor absoluto. Normalmente se encuentran entre
50 a 250/mm³. Un valor mayor a 1000/mm³ se considera
eosinofilia. Ésta es habitual en las EP pero no es
constante. En cambio, en muestras representativas de
parénquima pulmonar como el LBA importa el valor porcentual,
existiendo menos de 2% de eosinófilos en individuos
normales. Un recuento entre 2 y 25% puede hallarse en
neumopatías inflamatorias no específicas, por ello, el punto
de corte para considerar eosinofilia alveolar es de 25% para
la neumonía eosinofílica aguda (NEA) y 40% para la NEC 6.
La NEC es una EP de causa desconocida1-4. La mayor
incidencia ocurre en la 5º década de la vida y predomina en
el sexo femenino. Los síntomas se instalan en semanas o
meses, siendo los más frecuentes la tos, fiebre, pérdida de
peso, disnea, sudoración nocturna. El diagnóstico definitivo
desde el inicio del cuadro suele ser de varios meses. En el
50% de los casos existe el antecedente de asma de reciente
comienzo7. Los infiltrados radiológicos suelen ser
opacidades mal definidas, periféricas, sin distribución
lobar o segmentaria8. Puede haber migración de los
infiltrados. La imagen clásica de negativo del edema agudo
de pulmón se observa en menos del 25% de los casos y no es
específica6 - 8. La insuficiencia respiratoria aguda es
excepcional y, en ese caso, debe plantearse el diagnóstico
de NEA. Ésta cursa en forma fulminante y, no es frecuente el
hallazgo de eosinofilia periférica, sino que el diagnóstico
se establece por el hallazgo de eosinofilia alveolar en el
LBA9.
Con respecto al caso clínico descripto, se trataba de un
paciente inmunocompetente, con una neumonía de la comunidad
de bajo riesgo10, sin respuesta al tratamiento con
macrólidos. La evolución era subaguda, sin compromiso de
otros órganos y sin insuficiencia respiratoria. La imagen
tomográfica evidenció una neumonía multifocal, por ello se
planteó realizar una BFC, a fines de determinar con certeza
la etiología del cuadro. Ante la negativa del paciente se
inició el tratamiento antituberculoso. Pero en el
laboratorio de ingreso había leucocitosis y en ese momento
no se determinó la fórmula leucocitaria. Este dato, por lo
tanto, fue ignorado y, fue uno de los factores, a nuestro
entender, que retrasó el diagnóstico. Tras el reingreso del
paciente al servicio se halla la eosinofilia y se redefine
como EP. La BFC confirmó la eosinofilia alveolar. No se
hallaron causas definidas de EP, como ABPA, parasitosis,
vasculitis. La respuesta clínica a la corticoterapia fue
buena, pero no dramática como está clásicamente descripta 2
- 9.
La comunicación del presente caso es útil para recordar un
grupo de entidades que tienen la eosinofilia como dato
relevante. Es oportuno considerar el recuento leucocitario
diferencial en todo paciente con neumopatía, ya que, es
clave para sospechar las EP y realizar el diagnóstico de
patologías, que son poco frecuentes, pero pasibles de un
tratamiento efectivo.
|
CLASIFICACIÓN DE ALLEN J. |
|
| |
Eosinofilia Pulmonar Simple
(Síndrome Löeffler) |
| |
Neumonía Eosinofílica
Crónica |
|
Eosinofilias Pulmonares |
Neumonía Eosinofílica
Aguda |
|
|
Síndrome hipereosinofílico |
|
|
Aspergilosis Broncopulmonar
Alérgica |
|
|
Granulomatosis
Broncocéntrica |
|
|
Síndrome de Churg-Strauss |
|
Enfermedades
Asociadas a Eosinofilias |
Infecciones por parásitos |
|
|
Granuloma Eosinófilo |
| |
Infecciones por hongos |
| |
Neoplasias Hematológicas |
| |
Atopía |
| |
Misceláneas |
|
Bibliografía
1- Reader WH, Goodrich BE: Pulmonary infiltrates with
eosinophilia (PIE syndrome). Ann Intern Med 1952; 36:
1217-40.
Abstract
2-Carrington CB, Addington WW, Golf AM, Madoff IM, Marks A.,
Schwaber JR, Gaensler EA. Chronic eosinophilic pneumonia. N
Engl J Med 280:787-798, 1969.
3- Liebow AA, Carrington CB: The eosinophilic pneumonias.
Medicine, 1969; 48: 251-85.
4- Allen JN, Davis BW: Eosinophilic lung diseases. Am J
Respir Crit Care Med 1994; 5:1423-38.
5- Allen JN, Magro C, King M. The eosinophilic pneumonias,
Seminars in Respiratory and Critical Care Medicine, 2002;
2(23): 127-134.
6- Contrera M, Eosinofilias pulmonares. Neumonología y
cirugía de tórax, Vol. 65(S3):S47-S55, 2006.
Full Text
7- Marchand E., Etienne-Mastroianni B., Chanez P., Lauque
D., Leclerc P. Idiopathic chronic eosinophilic pneumonia and
asthma: how do they inluence each other? Eur Respir J 2003;
22: 8-13.
Full Text
8- Carrington C.B, Gaensler E. Peripherial opacities in
chronic eosiniphilic pneumonia: the photographic negative of
pulmonary edema. Am J Roentgenol 1977; 128:1-13.
9- Robles A.M., Casas J.P., Pereyra M.A., Garzón R, Lopez
A.M., Neumonía eosinofílica aguda. Medicina (Buenos aires)
2000; 60: 605-608.
Full Text
10- Fine Michael J. y col. A prediction rule to identify
low-risk patients with community acquired pneumonia. N Engl
J Med 336: 243-250, 1997.
Full Text

|