TRABAJO DE REVISIÓN
Aspectos críticos de abuso de hormonas
protéicas en el ejercício y en el deporte: actualización.
Critical aspects of peptide hormone abuse in exercise and
sports: an update.
Carlos Kusano Bucalen Ferrari
Revista Facultad de Ciencias Medicas 2013; 70(3):153-162
Biomedical Nutritional and
Epidemiologic Research Group (BIONUTRE),
Campus Universitário do Araguaia, Universidade Federal de
Mato Grosso (UFMT).
E-mail:
ferrariphd@yahoo.com.br
Introducción
La búsqueda desenfrenada por
propasar los límites físicos y quien sabe, vencer una
competición o también conseguir un cuerpo “perfecto” ha
llevado millones de jóvenes, especialmente hombres del mundo
entero al uso de sustancias prohibidas. Tavares1, citando la
Conferencia Mundial sobre Doping en el Deporte (1999),
define al doping como “el uso de un artificio, substancia o
método potencialmente peligroso para la salud del atleta y/o
capaz de aumentar su rendimiento, o bien la presencia en el
cuerpo del atleta de una substancia o una constatación de un
método presente en la lista anexa al Código de Movimiento
Olímpico Anti-Doping. De este modo, es notable el carácter
antiético, ilegal y perjudicial a la salud el uso de
substancias prohibidas en el ejercicio y en el deporte,
conforme a las determinaciones de la Agencia Mundial Anti-Doping
(World Anti-Doping Agency, WADA, www.wada-ama.org), de
la Confederación Brasilera de Orientación (CBO,
www.cbo.org.br) y del Comité Olímpico Brasilero (COB,
www.cob.org.br).
Así mismo, el uso de substancias prohibidas, especialmente
hormonas, continua muy difundido en nuestro medio,
principalmente en Gimnasios. Este articulo tiene como
objetivo informar y educar a los estudiantes, profesionales
de educación físicas y de la salud y del público en general
sobre los mecanismos de acción, efectos y riesgos a la salud
causados por el abuso de hormonas proteicas.
Aun de modo claro o ignorado por el usuario, el objetivo del
uso de hormonas proteicas es promover un conjunto de
reacciones bioquímicas de síntesis (producción) y
almacenamiento de biomolecular (carbohidratos, proteínas,
lípidos, ADN/RNA) y de energía (ATP/GTP), conocido como
anabolismo. De modo simple, podemos considerar el catabolismo
como lo contario de anabolismo, o sea, son las reacciones de
degradación de macromoléculas y de ATP. El conjunto formado
por la compleja red de reacciones bioquímicas de anabolismo
y catabolismo es llamado de metabolismo. Así, se entiende por
anabolismo muscular al aumento de síntesis de proteínas que
componen las fibras musculares, conocidas como proteínas
micro fibrilar (actina, miosina, tetina, etc.)2. El ejercicio
físico, hormonas, medicamentos, nutrientes, y otros
estímulos inducen el ADN (ácido desoxirribonucleico) a
producir RNA (ácido ribonucleico) y este, a su vez, determina
la producción de nuevas proteínas en la célula. El aumento de
anabolismo muscular provoca un incremento en el volumen de
las células musculares, fenómeno conocido como hipertrofia
muscular.3 Anatómicamente, la hipertrofia muscular significa
aumento del diámetro o en la sección transversal de un
músculo. Un problema concreto es que no siempre la hipertrofia
muscular está asociada al aumento de proteínas
miofibrilares, pues puede ocurrir solo una acumulación de
agua en el citoplasma de la célula muscular. Considerando
las células musculares, el tipo ideal de molécula (hormona o
nutriente) anabólica seria aquella que pueda inducir la
producción de miofibrilares, sin, por ello llevar a la
síntesis de proteínas anómalas. La verdad, gran parte de
los estudios científicos han demostrado que sustancias
llamadas anabólicas generalmente no inducen a la síntesis de
proteínas miofibrilares, sino solo aumentan la producción de
colágeno ( principal proteína del tejido conjuntivo que
forma parte de los tejidos de sostenimiento de nuestro
cuerpo) y/o provocan acumulación intracelular de agua,
conocido también como degeneración hidrópica o edema
celular.4 El edema celular, es muy común en la musculatura
cardiaca (miocardio), causa palidez y aumento del peso del
órgano, estando asociado a isquemia, o sea, reducción del
flujo sanguíneo, anoxia, o falta de oxígeno, en las células
del tejido y/u órgano afectado.5
Objetivo
El objetivo de este estudio fue describir y evaluar
críticamente el uso y abuso de las principales hormonas
proteicas utilizadas en el ejercicio y el deporte de acuerdo
con los informes clínicos, el estudio experimental
controlado publicado en la literatura científica.
Insulina
La insulina es una hormona proteica, que consiste en 65
aminoácidos (51 en forma activa), sintetizado por las
células beta de los ilotas pancreáticos, y que desempeña un
papel crucial en el transporte da glucosa en la sangre al
interior de las células, así como estimuladores de
la síntesis de glucógeno, nuestra principal reserva de
carbohidratos en los músculos esqueléticos y el hígado. Se
estima que nuestro organismo pueden tener sobre 72g de
glucogénico hepático y 245g de glucógeno muscular, siendo la
insulina un excelente anabólico, ya que estimula la síntesis
proteica e inhibe el catabolismo muscular.2
El mecanismo de acción de la insulina y el IGF-1 (factor de
crecimiento insulina) se ejecuta a través de la tras membrana
tirosina quinasa. En la membrana citoplasmática de las
células sensibles a la insulina (músculo, neuronas,
adipocitos, etc.), hay receptores para esta hormona. El
receptor es un tetrámero, presentando dos subunidades α y dos
β. La insulina se une a las subunidades α, activando la
tirosina quinasa en la subunidad β, que recibe fósforo del ATP,
tornándose fosforada. La tirosina quinasa fosforila formaran
varias proteínas que tendrán acción de transcripción nuclear,
o sea, en la activación de genes para la síntesis proteica.
El complejo del insulano-receptor es internalizado por
endocitosis para que la insulina sea metabolizada. Además,
la insulina también se puede unir al retículo endoplasmático,
el aparato de Golgi yactuar directamente en el núcleo
induciendo la transcripción génica a través de IGF-1 e IGF-2.6-7,
El uso de la insulina en carreras deportivas fue prohibido
por el Comité Olímpico Internacional en 1998, ya que esta
hormona proteica aumenta la concentración intracelular de
glucosa, contribuyendo para el anabolismo muscular y para la
síntesis y almacenamiento de glucógeno, que puede traer
beneficios para el rendimiento físico de los atletas.2,8 Por
otra parte, aunque no hay informes en la literatura médica
brasilera, se sabe que existe el uso de la insulina
en gimnasios y centros de estética. Un estudio realizado en
Reino Unido, con una muestra de personas frecuentadoras de un
gimnasio, mostró que 70% utilizaron esteroides anabolizantes,
produciéndose un aumento del 14% y 24% en el uso de insulina
y de GH, respectivamente.9
En este sentido, los individuos que hacen uso de la insulina
durante un período prolongado tienen el riesgo de
desarrollar insuficiencia pancreática y diabetes mellitus
tipo 2, esto es porque el exceso de insulina
es una señal inhibidora de la secreción insulínica por el
páncreas en conformidad con el principio do feedback
negativo. Como no hay estudios en este sentido, no se sabe bien
si existiera resistencia a la acción de la insulina,
un defecto en el que los receptores no acoplan la hormona debido
al exceso del mismo, en personas que aplicaron dosis supra
fisiológicas de la hormona durante varios meses. Sin
embargo, en los individuos que tienen resistencia a la
insulina (estado pre-diabético) esta hormona aumenta
excesivamente la acción del sistema renina-angiotensina-aldosterona,
promoviendo intensa reabsorción renal de sodio y, por lo
tanto, aumento del agua y de la volemia, pudiendo contribuir
para la hipertension.10 Además, la
híperinsulinemia crónica induce la liberación de
glucocorticoides que ejercen feedback negativo bajo
el páncreas inhibiendo la secreción de insulina.11 Debido a su
acción, la insulina puede tener el efecto de la hipoglucemia.
Su exceso puede inducir hipoglucemia con graves
consecuencias. Elkin et al.12 relataron el caso de un
fisiculturista de apenas 21 años que desarrolló un severo
daño cerebral (debido a la hipoglucemia) por el uso de la
insulina inyectable. Por otra parte, el estudio de Boileau
et al.13 reportó la ocurrencia de 332 casos recurrentes de
coma hipo glucémico por errores en la aplicación de dosis de
la hormona. Por lo tanto, la aplicación de hormonas debe ser
supervisada por un profesional de la salud después de la
prescripción médica, ya que constituye un riesgo a la salud
humana.
Hormona del crecimiento (GH) o somatotrofina
Se trata de una hormona proteica, constituida por 191
aminoácidos formando una única cadena poli peptídica, que
es sintetizado, almacenado y segregado por las células
somatotróficas de las porciones laterales de
la glándula ademo hipófisis en el Sistema Nervioso Central.
Segregada por la hipófisis anterior la GH tiene un efecto
importante en el crecimiento físico del niño. Muchos de los
casos en que el niño no crece adecuadamente son porque
hay insuficiencia en la secreción de GH. Por al contrario, en
los ancianos ocurre una disminución progresiva de la GH que
explica en parte la reducción del tamaño de las personas en
esta etapa de vida.
Hay varios factores que reducen la producción de GH, como la
hormona cortisol, los ácidos grasos libres, la glucosa,
el estrés psicológico y disturbios del sueño14. Por otro lado,
el glucazón, la hipoglucemia, el ayuno, los ejercicios
físicos, el sueño, la concentración en la sangre de
androgénicos y estrógenos, así como el aumento de
la concentración en la sangre de aminoácidos son factores que
estimulan la producción de GH14.
Entre los efectos fisiológicos de GH, podemos citar7,14
• La estimulación de la lipólisis (degradación de la grasa en
los adipocitos o células de grasas);
• Formación de glucogénico en el hígado y los músculos;
• Disminución de la glicólisis;
• Aumento de la producción de colágeno.
GH no parece aumentar la masa muscular
Uno de los mayores mitos es el uso de GH en la musculación
con el propósito de la hipertrofia. El GH no aumenta la
producción de la actina y miosina, ni la fuerza muscular15.
Un estudio clínico, o sea, de intervención en el ser humano,
doble ciego (ni el investigador, ni el paciente sabe si
están recibiendo la droga o el placebo – substancia sin
efecto) y controlado (muestra grupo del control que recibe
el placebo y los grupos experimentales que reciben la droga)
determinó que la administración de dosis por arriba de los
niveles normales (dosis supra fisiológicas) de GH aumentó
solo un 2,7% de peso corporal y en 5,3% de la masa libre de
grasa (contiene agua y músculo), reduciendo, de este modo,
en6,6% la grasa corporal. Sin embargo, los autores señalan
que este aumento de masa libre de grasa se debe a un aumento
de concentración intracelular de agua (9,6%) y no por causa
de una mayor síntesis proteica muscular.16,17. Otros
estudios revisados por Doessing e Kjaer18 demostraron que la
GH tiene un efecto modesto sobre la síntesis de proteínas
miofibrilares, pero aumenta sustancialmente la producción de
colágeno en el tejido conjuntivo.
Como toda sustancia, puede tener efectos perjudiciales para
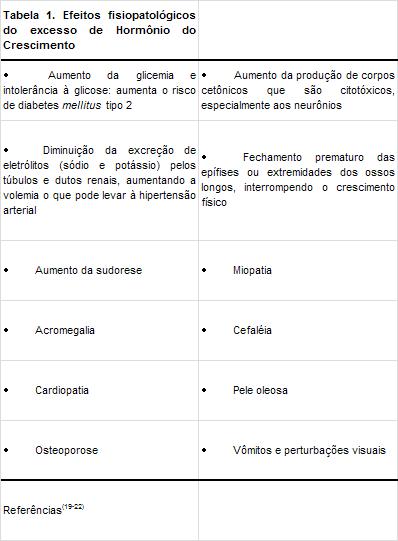
la salud, e exceso de GH puede causar (Tabla 1).El uso de la GH en atletas entrenados aumento la glucemia,
los niveles de glicerol y de lactato en la sangre, afectando
el rendimiento físico en la bicicleta ergométrica.23
 |
Cuidado: La GH puede causar hipertensión!
Fisiculturistas y practicantes de musculación pueden
presentar exceso de GH que provoca una mayor activación del
sistema renina-angiotensina-aldosterona20,24, aumentando la
reabsorción renal de sodio yagua, o sea, la retención de
líquidos17, lo que se traduce en un aumento del
volumen sanguíneo (volemia), pudiendo contribuir
decisivamente a la génesis de la hipertensión arterial. La
activación del sistema renina-angiotensina-aldosteronatambiéninducela
vasoconstricción que aumenta la presión arterial.
El exceso de GH, que ocurre en la acromegalia (síndrome
causado por la producción excesiva de GH en los adultos),
también aumenta la volemia por la disminución del peptíde o
natriurético atrial, hormona que reduce la retención de sodio
y líquidos. El exceso de GH puede inducirla apnea obstructiva
del sueño y estimular el sistema nervioso autónomo simpático
(adrenalina/noradrenalina), causando también la
hipertensión25. Finalmente, el exceso de GH causa
remodelación o engrosamiento de la pared
arterial, híperinsulinemia y la disfunción endotelial que
aumentan la resistencia vascular periférica. Esto significa un
aumento del tono vascular, o sea, el vaso sanguíneo se torna
más espeso y pierde su elasticidad por lo que la sangre debe
ejercer mayor presión sobre su pasaje. El resultado
es también la hipertensión25. Uno de los principales problemas
de los pacientes hipertensos es la aparición de hipertrofia
o engrosamiento de la pared ventricular del corazón,
especialmente del lado izquierdo, que determina
la insuficiencia cardiaca congestiva. Recientemente, en los
pacientes hipertensos fue constatado una asociación positiva
entre la hipertrofia del ventrículo izquierdo, hipertensión
arterial y niveles sanguíneos de GH.26
Practicar ejercicios físicos y dormir bien: así de simple?
De este modo es evidente que el uso de hormonas solo puede
ser realizado sobre estricto control de su médico. Por eso,
es importante tener siempre una buena noche de sueño, porque
el GH es segregado en picos durante la madrugada y practicar
ejercicios físicos regularmente para evitar laacúmulacion de
grasa visceral (abdominal) y el sedentarismo, factores que
disminuyen la síntesis de GH.27 Según WIDEMAN et al.28 hay una
curva de dosis-respuesta entre la síntesis de GH yla
intensidad del ejercicio físico, o sea, cuanto mayor es la
intensidad del ejercicio, mayor la producción de hormonas.
Comparando ejercicios aeróbicos con la combinación de estos
ejercicios y los ejercicios resistidos, la combinación fue más
eficaz en aumentar los niveles de GH post-ejercicio.29
Evidentemente que hay un limite y no se debe exagerar en
los ejercicios, porque pueden producirse efectos contrarios.
Recientemente, el uso de elevadas dosis de GH reducirían la
grasa corporal y aumentaran la capacidad de “sprint” en
atletas.18 Por ello, otros estudios recientes demostraron que
el uso supra fisiológico de GH en atletas masculinos
reducía la producción de hormonas estimulantes de la tiroides
(TSH), esto significa que el uso de GH puede causar
hipotiroidismo.
IGF-1 y Cáncer: la unión entre GH e Insulina
La GH y la insulina, como otras hormonas peptídicas,
generalmente no consiguen entrar en la célula; así, sus
acciones dependen de un intermediario – el factor de
crecimiento insulínico-1 (IGF-1) o somatomedina que va a
realizar en el núcleo de la célula transmitiendo el mensaje
químico de estos horminos. De acuerdo con Machado31, o IGF-1
es uno de los principales factores responsables por síntese
proteica y transporte de aminoácidos y de glucosa para los
músculos y el hígado.
Los efectos de la acción de la GH y de la insulina, vía IGF-1,
comprenden aumento de la proliferación de adipocitos (células
grasosas), o envejecimiento celular y corporal, inhibición
de muerte de células cancerígenas e proliferación de las
mismas.6,32,33 Como consecuencia aumenta el riesgo de
tumores malignos de colon (intestino), recto, pulmón,
páncreas, endometrio (útero), mama y próstata.15,32,34 Hay
que resaltar que existen nuevas regulaciones restrictivas en
el deporte, con mejores métodos de detección química y
puniciones a los atletas deben ser adoptadas para evitar el
“doping” genético que ya es practicado en relación a la
producción de IGF-1 y de eritropoitina.35
Eritropoyetina (EPO)
Producida en los riñones, la eritropoyetina es una
glicoproteína conun peso molecular de 34KD que presenta
cuatro sitios de glicolisacion para la unión de azúcares. Esta
hormona esesencial para la producción y renovación de
los eritrocitos sanguíneos, así como de las células
musculares esqueléticas.36 Además, la eritropoyetina aumenta
la fosforilacion oxidativa mitocondrial, así como la
actividad del sistema transportador de electrones de células
musculares lo que aumenta el metabolismo aeróbico. Su uso
terapéutico está limitado a los pacientes con anemia, debido
el cáncer y la insuficiencia renal. Sin embargo, la EPO ha
sido detectada como doping en los atletas de ciclismo,
triatlón y maratón, una vez que aumenta el número de
eritrocitos y, por tanto, de hemoglobina, aumentando el
consumo máximo de oxigeno (VO2Max), o sea, la capacidad
aeróbica, lo que significa mayor rendimiento físico.38 La
EPO aumenta significativamente la cantidad de
eritrocitos jóvenes, además de reducirlos daños causados por
radicales libres del oxígeno y mejora el humor de la
persona.39 La administración de EPO también aumentó la
capacidad física de los pacientes con insuficiencia cardíaca
congestiva.40 Aunque no hay datos en la literatura, se sabe
que su uso indebido está difundido en practicantes de
musculación. La EPO es capaz de inducirla producción del
factor quimio táctico de monócitos-1 MCP-1), lo que aumenta
el proceso inflamatorio en la pared arterial, y de reducirla
capacidad de vaso dilatación arterial por la disminución de
la producción de óxido nítrico.41 Lareducción de ON compromete
la capacidad de vasodilatación arterial, provocando la
llamada disfunción endotelial42 que es un factor importante
en la patogenia tanto de la arterosclerosis como de la trombosis,
porque la deficiencia de ON aumenta la activación de
plaquetas, células implicadas en los procesos
aterotrombóticos.43 Hoy en día ya hay textos en la literatura
científica asociando el uso de EPO con el aumento del riesgo
de estrechamiento o de las arterias (estenosis) y trombose.44 La
propagación de la migración de macrófagos también es un
factor esencial en la patogenia de la arteroesclerosis.45
Además de la aterosclerosis y de la trombosis, la EPO en exceso
puede provocar la hipertensión pulmonar (cor pulmonale) e
hipertensión sistémica, en este caso en pacientes
con insuficiencia renal, especialmente con uremia
(acumulación de urea en la sangre), una vez que lo
hormona induce la producción de sustancias vaso constrictoras,
como la endotelina-1 y la tromboxana-A2.46,47 Recientemente,
fue evidenciado que la eritropoyetina disminuye la reabsorción
en los túbulos próximos, reduciendo significativamente la
tasa de filtración glomerular en humanos.48 Uno de los
principales efectos colaterales del tratamiento de anemia con
EPO esla hipertensión arterial sistémica o pulmonar.49 En un
estudio interesante de manipulación génica, con roedores que
producían exceso de EPO, había un exceso en la producción de
eritrocitos y degeneración muscular, renal, hepática y de
neuronas.50
Hormona de la tiroides
Localizada en la base del cuello, la
glándula tiroides produce dos hormonas fisiológicamente activas,
la triiodotironina (T3) y la tetraiodotironina (T4) o
tiroxina.7 Como estas hormonas aumentan el metabolismo
energético, hay mayor degradación de grasa y por eso inducen a
adelgazar. Por causa de ello, su uso indiscriminado,
sin acompañamiento médico, ha sido difundido entre
practicantes de ejercicios físicos y personas que quieren
tener un cuerpo “saludable” y más próximo a la “perfección”.
Entretanto, su uso no está exento de diversos efectos
colaterales. T3 y T4 provocan catabolismo energético,
llevando al aumento de la temperatura corporal,
sudor excesivo, temblores, debilidad muscular, aumento del
débito o trabajo cardíaco y dificultades respiratorias. Aunque
aumente el débito cardíaco, la tiroxina induce a la muerte
celular programada (apoptosis) y reduce la contractilidad de
miocardiocitos.51 Además de ello, la tiroxina provoca pérdida
de masa muscular19 y aumenta la producción de radicales
libres y la oxidación de lipídicos los que pueden llevar a
la degeneración de los testículos y del hígado.52
Layzer & Goldfiled53 reportaron tres casos de parálisis de
los miembros inferiores provocada por el uso de píldoras para
adelgazar.
Así como las otras hormonas, el control de la secreción de las
hormonas tiroideas depende del mecanismo de feedback
negativo. La glándula hipófisis produce la hormona estimulante
de la tiroides (TSH) tirotrofina, que activa la tiroides para
la producción de sus hormonas. Por ello,
concentraciones excesivas de T3 e T4 inducen una supresión del
TSH en la hipófisis y también una supresión directa debajo de
la propia glándula tiroides. Como resultado, se vela
tirotoxicosis o intoxicación de la tiroides en la que el
paciente presenta taquicardia, pérdida de peso, bocio
(hipertrofia o aumento del volumen de la glándula tiroides) e
parálisis motora con gran pérdida urinaria de potasio que
resulta en baja concentración sanguínea del mismo (hipocalemia).54,55 El
abuso de hormonas tiroideas también pueden ocasionar falencia
glandular e hipotiroidismo, estado en que el paciente
presenta bajo metabolismo, hipotermia, cansancio físico e
dificultades para bajar de peso. Scally &
Hodge56 relataron dos casos de hipotiroidismo provocados por
el abuso de tiratricol, producto comercial derivado de T3,
para fines de adelgazamiento. Del mismo modo,
Pickett57 describe un caso clínico de
tirotoxicosis e hipotiroidismo en un paciente que utilizo
L-tiroxina de origen veterinario para adelgazar.
El hipertiroidismo ha sido clínicamente asociado a
la resistencia insulínica y síndrome
metabólico.58 Recientemente se observó que tanto
el hipotiroidismo como el hipertiroidismo están asociados
al mayor riesgo de resistencia insulínica en pacientes
humanos.59
Conclusión
Por más difícil y costoso que sea el cambio de hábitos, es
fundamental practicar ejercicios físicos, controlar el estrés
psicológico y tener una alimentación adecuada para mejorar el
desempeño físico. El uso de hormonas proteicas, solo debe ser
realizado cuando sea prescrito por el médico; caso
contrario, puede constituir portación ilegal de substancias
y tráfico de drogas, como causar problemas para la salud.
Bibliografía
1. Tavares, O. Notas para uma análise da produção em
Ciências Sociais sobre doping no esporte. Esporte Soc; 2006,
1(2) Março/Junho. Disponívelem URL: [http://www.lazer.eefd.ufrj.br/espsoc/html/es206.html ].
[13/10/2012].
2. Maughan R, Gleeson M, Greenhaff PL. Bioquímica do
exercício e do treinamento. São Paulo, Editora Manole, 2001.
3. Bucci M, Vinagre EC, Campos GER, Curi R, Pithon-Curi TC.
Efeitos do treinamento concomitante sob a hipertrofia e
endurance no músculo esquelético. Rev Brasil Ciênc Movim;
2005; 13: 17-28.
Full text
4. Clement PB, Young RH, Scully RE. Diffuse, perinodular,
and other patterns of hydropic degeneration within and
adjacent to uterine leiomyomas. Problems in differential
diagnosis. Am J Pathol; 1992, 16: 26-32.
PubMed
5. Camargo JLV de, Oliveira DE de (Orgs). Patologia Geral.
Abordagem Multidisciplinar. Rio de Janeiro, Editora
Guanabara-Koogan, 2007. p.39-40.
6. Raw I, Ho PL. Integração e seus sinais. São Paulo,
Editora UNESP, 1999. p.95-98.
7. Costanzo LS. Fisiologia endócrina. In: Fisiologia. Rio de
Janeiro, 2ªed., Editora Elsevier, 2004, Cap. 9, p. 359-421.
8. Green GA. Insulin as an anabolic drug of abuse in sport?
Diab Technol Therap 2004, 6: 387-388.
PubMed
9. Baker JS, Graham MR, Davies B. Steroid and prescription
medicine abuse in the health and fitness community: a
regional study. Eur J Inter Med; 2006, 17: 479-484.
PubMed
10. Endre T, Mattiasson I, Berglund G, Hulthein UL. Insulin
and renal sodium retention in hypertension-prone men.
Hypertension; 1994, 23: 313-319.
PubMed
11. Ferrari CKB. Fisiopatologia e Clínica da Síndrome
metabolica. Arq Catar Med 2007; 36(4): 90-95.
12. Elkin SL, Brady AS, Williams IP. Bodybuilders find it
easy to obtain insulin to help them in training. British
Medical Journal, 1997; 314: 1280.
Full Text
13. Boileau P, Aboumrad B, Bougnères P. Recurrent comas due
to secret self-administration of insulin in adolescents with
type I diabetes. Diabetes Care 2006; 29: 430-431.
Full text
14. Ganong WF. Fisiologia médica. Rio de Janeiro, Editora
McGraw-Hill Interamericana do Brasil, 2007.
15. Adams GR. Insulin-like growth factor in muscle growth
and its potential abuse by athletes. Brit J Sport Med, 2000;
34: 412-413.
Full text
16. Ehrnborg C, Ellegård L, Bosaeus I, Bengtsson B-Å, Rosén
T. Supraphysiological growth hormone: less fat, more
extracellular fluid but uncertain effects on muscles in
healthy, active young adults. Clin Endocrinol 2005; 62:
449-457.
PubMed
17. Meinhardt U, Nelson AE, Hansen JL, Birzniece V, Clifford
D, Leung K-C, Graham K, Ho KKY. The effects of growth
hormone on body composition and physical performance in
recreational athletes. Ann Intern Med 2010; 152: 568-577.
PubMed
18. Doessing S, Kjaer M. Growth hormone and connective
tissue in exercise. Scand J Med Sci Sport 2005; 15(4):
202-210.
PubMed
19. Anatomical Chart Company. Atlas de Fisiopatologia. Rio
de Janeiro, Editora Guanabara-Koogan, 2004.
20. Ashraf A, McCormick K. Hyperreninemia and
hypoaldosteronism in a child with short stature.
Endocrinologist 2004; 14: 313-316.
21. Calfee R, Fadale P. Popular ergogenic drugs and
supplements in young athletes. Pediatrics 2006; 117:
e577-e589.
Full text
22. Barroso O, Mazzoni I, Rabin O. Hormone abuse in sports:
the antidoping perspective. Asian J Androl 2008; 10: 391-402
PubMed
23. Lange KHW, Larsson B, Flyvbjerg A, Dall R, Bennekou M,
Rasmussen H, Ørskov H, Kjær M. Acute growth hormone
administration causes exaggerated increases in plasma
lactate and glycerol during moderate to high intensity
bicycling in trained young men. J Clin Endocrinol Metab
2002; 87: 4966-4975.
PubMed
24. Hanukoglu A, Belutserkovsky O, Phillip M. Growth hormone
activates renin-aldosterone system in children with
idiopatic short stature and in a pseudohypoaldosteronism
patient with a mutation in epithelial sodium channel alpha
subunit. J Steroid Biochem Mol Biol 2001; 77: 49-57.
PubMed
25. Fountoulakis S, Tsatsoulis A. Molecular genetic aspects
and pathophysiology of endocrine hypertension. Hormones
2006; 5: 90-106.
Full text
26. Sesti G, Sciacqua A, Scozzafava A, Vatrano M, Angotti E,
Ruberto C, Santillo E, Parlato G, Perticone F. Effects of
growth hormone and insulin-like growth factor-1 on cardiac
hypertrophy of hypertensive patients. J Hypertens 2007; 25:
471-477.
PubMed
27. Weltman A, Desprès JP, Clasey JL, Weltman JY, Wideman L,
Kanaley J, Patrie J, Bergeron J, Thorner MO, Bouchard C,
Hartman ML. Impact of abdominal visceral fat, growth hormone,
fitness, and insulin on lipids and lipoproteins in older
adults. Metabolism Clin Exper 2003; 52: 73-80.
Full Text
28. Wideman L, Weltman JY, Hartman ML, Veldhuis JD, Weltman
A. Growth hormone release during acute exercise and chronic
aerobic and resistance exercise: recent findings.Sports Med
2002; 32: 987-1004.
Full text
29. Seo DI, Jun TW, Park KS, Chang H, So WY, Song W. 12
weeks of combined exercise is better than aerobic exercise
for increasing growth hormone in middle-aged women. Int J
Sport Nutr Exerc Metab 2010;20(1):21-26.
PubMed
30. D’armiento M, Lenzi A, Luigi LD. Effect of supra-physiological
dose administration of rGH on pituitary-thyroid axis in
healthy male athletes. Regul Pept. Accepted:
http://dx.doi.org/10.1016/j.regpep.2010.06.010
31. Machado M. O papel dos micro-traumas e das células
satélite na plasticidade muscular. Arq Movim 2007; 3:
103-117.
32. Kaaks R. Nutrition, insulin, IGF-1 metabolism and cancer
risk: a summary of epidemiological evidence. Novartis Found
Symp 2004; 262: 247-260.
PubMed
33. Brown-Borg HM, Rakoczy SG, Sharma S, Bartke A.
Long-living growth hormone receptor knock out mice:
potential mechanisms of altered stress resistance. Exp
Gerontol 2009; 44: 10-19.
PubMed
34. Rowlands MA, Gunnell D, Harris R, Vatten LJ, Holly JMP,
Martin RM. Circulating insulin-like growth factor (IGF)
peptides and prostate cancer risk: a systematic review and
meta-analysis. Int J Canc 2009; 124: 2416-2429.
PubMed
35. Fore J. Moving beyond gene doping: Preparing for genetic
modification in sport. Virginia J Law Technol 2010; 15:
77-100.
Full text
36. Jia Y, Suzuki N, Yamamoto M, Gassmann M, Noguchi CT.
Endogenous erythropoietin signaling facilitates skeletal
muscle repair and recovery following pharmacologically
induced damage. Faseb J 2012; 26(7): 2847-2858.
PubMed
37. Plenge U, Belhage B, Guadalupe-Grau A, Andersen PR,
Lundby C, Dela F, Stride N, Pott FC, Helge JW, Boushel R.
Erythropoietin treatment enhances muscle mitochondrial
capacity in humans. Front Physiol 2012; 3: 50.http://dx.crossref.org/10.3389/fphys.2012.00050
[08/11/2012].
38. Robinson N, Giraud S, Saudan C, Baume N, Avois L, Mangin
P, Saugy M. Erythropoietin and blood doping. Brit J Sports
Med 2006; 40(n.suppl.1): i30-i34.
Full text
39. Böning D, Maassen N, Pries A. The hematocrit paradox-
how does blood doping really work? Int J Sports Med 2011;
32: 242-246.
Full text
40. Mancini DM, Katz SD, Lang CC, LaManca J, Hudaihed A,
Androne A-S. Effect of erythropoietin on exercise capacity
in patients with moderate to severe chronic heart failure.
Circulation 2003; 107: 294-299.
Full text
41. Desai A, Zhao Y, Lankford HA, Warren JS. Nitric-oxide
suppresses EPO-induced monocyte-chemoattractant protein-1 in
endothelial cells: implications for atherogenesis in chronic
renal disease. Lab Invest 2006; 86: 369-379.
PubMed
42. Kawashima S, Yokoyama M. Dysfunction of endothelial
nitric oxide synthase and atherosclerosis. Arterioscl Thromb
Vasc Biol 2004; 24: 998-1005.
Full text
43. Loscalzo J. Nitric oxide insufficiency, platelet
activation, and arterial thrombosis. Circ Res 2001; 88:
756-762.
Full text
44. Maiese K, Chong ZZ, Shang YC. Raves and risks for
erythropoietin. Cytok Growth Fact Rev 2008; 19: 145-155.
Full text
45. Deo R, Khera A, McGuire DK, Murphy SA, Melo-Neto J de P,
Morrow DA, Lemos JA de. Association among plasma levels of
monocyte chemoattractant protein-1, traditional
cardiovascular risk factors, and subclinical atherosclerosis.
J Amer Col Cardiol 2004; 44: 1812-1818.
PubMed
46. Brochu E, Lacasse-M S, Larivière R, Kingma I, Grose JH,
Lebel M. Differential effects of endothelin-1 antagonists on
erythropoietin-induced hypertension in renal failure. J Amer
Soc Nephrol 1999; 10: 1440-1446.
Full text
47. Rodrigue ME, Moreau C, Larivière R, Lebel M.
Relationship between eicosanoids and endothelin-1 in
erythropoietin-induced hypertension in uremic rats. J
Cardiovasc Pharmacol 2003; 41: 388-395.
PubMed
48. Olsen NV, Aachmann-Andersen N-J, Oturai P, Munch-Andersen
T, Bornø A, Hulston C, Holstein-Rathlou N-H, Robach P,
Lundby C. Erythropoietin down-regulates proximal renal
tubular reabsorption and causes a fall in glomerular
filtration rate in humans. J Physiol 2011; 589: 1273-1281.
Full text
49. Lee MS, Lee JS, Lee JY. Prevention of erythropoietin-associated
hypertension. Hypertension 2007; 50: 439-445.
PubMed
50. Heinicke K, Baum O, Ogunshola OO, Vogel J, Stallmach T,
Wolfer DP, Keller S, Weber K, Wagner PD, Gassmann M, Djonov
V. Excessive erythrocytosis in adult mice overexpressing
erythropoietin leads to hepatic, renal, neuronal, and
muscular degeneration. Am J Physiol Integr Comp Physiol
2006; 291: R947-R956.
Full text
51. Wang Y-Y, Jiao B, Guo W-G, Che H-L, Yu Z-B. Excessive
thyroxine enhances susceptibility to apoptosis and decreases
contractility of cardiomyocytes. Mol Cell Endocrinol 2010;
320: 67-75.
PubMed
52. Chandra AK, Sinha S, Choudhury SR. Thyroxine induced
stress and its possible prevention by catechin. Indian J Exp
Biol 2010; 48: 559-565.
Full text
53. Layzer RB, Goldfield E. Periodic paralysis caused by
abuse of thyroid hormone. Neurology 1974; 24: 949-952.
54. Wong P. Hypokalemic thyrotoxic periodic paralysis: a
case series. Can J Emerg Med 2003; 5: 353-355.
PubMed
55. Vale J, Canas N, Leal A, Vilar H. Paralisia periódica
tireotóxica. Acta Méd Portug 2005; 18: 399-402.
56. Scally MC, Hodge A. A report of hypothyroidism induced
by an over-the-counter fat loss supplement (Tiratricol). Int
J Sport Nutr Exerc Metab 2003; 13: 112-116.
PubMed
57. Pickett CA. An unusual case of central hypothyroidism
and thyrotoxicosis factitia. Endocrinologist 2006; 16:
219-222.
58. Kumar HK, Yadav RK, Prajapati J, Reddy CV, Raghunath M,
Modio KD. Association between thyroid hormones, insulin
resistance, and metabolic syndrome. Saudi Med J 2009; 7:
907-911.
PubMed
59. Kapadia KB, Bhatt PA, Shah JS. Association between
altered thyroid state and insulin resistance. J
PharmacolPharmacother 2012; 3(2):156-160.
Full text
|