|
ARTICULO ORIGINAL
Meta análisis sobre la eficacia y seguridad de la
hipotermia en el tratamiento de la encefalopatía
hipóxico isquémica.
Efficacy and segurity of
therapeutic hypothermia for hypoxic ischemic encephalopathy:
a meta-analysis
Alina Rizzoti, José Bas, Eduardo Cuestas
Revistad de la Facultad de Ciencias Médicas
2010, 67(1): 15-23
Servicio de Pediatría y
Neonatología. Hospital Privado Centro Médico de Córdoba.
Cátedra de Clínica Pediátrica. Facultad de Ciencias Médicas.
Universidad Nacional de Córdoba.
#Cátedra de Metodología de la Investigación y
Bioestadística. Facultad de Medicina. Universidad Católica
de Córdoba.
Correspondencia: Dr. E. Cuestas. Servicio de Pediatría y
Neonatología. Hospital Privado Centro Médico de Córdoba. Av.
Naciones Unidas 346. CP X5016KHE Córdoba-Argentina.
Teléfono: 0351-4688241. Fax: 0351-4688286. e-mail:
ecuestas@hospitalprivadosa.com.ar
INTRODUCCIÓN
La asfixia perinatal (AP) afecta a 5 de cada mil recién
nacidos vivos, como consecuencia de esto, entre uno y dos
por mil neonatos(1)
presentan encefalopatía hipóxico isquémica (EHI) en los
países desarrollados. La prevalencia de AP es de dos a diez
veces mayor en los países en vías de desarrollo, y explica
por sí sola, el veintitrés por ciento de las muertes
neonatales en todo el mundo
(2).
En Argentina la tasa de mortalidad por asfixia y traumatismo
perinatal fue en el año 2002 de 2,7 por 1000 recién nacidos
vivos
(3).
La EHI constituye un grave problema de salud a nivel global,
pues entre un treinta y un cincuenta por ciento de los
afectados muere a consecuencia de la misma, y alrededor de
un veinticinco y un sesenta por ciento de los sobrevivientes
presenta secuelas neurológicas moderadas o severas a largo
plazo
(4).
Durante los últimos años se han dilucidado tanto los
mecanismos de lesión celular primaria durante la asfixia,
como los que producen el daño neuronal secundario que le
sigue5, y que constituye actualmente, el objetivo de las
intervenciones terapéuticas.
Se ha demostrado que la hipotermia terapéutica moderada
posee un efecto protector tanto en animales como en seres
humanos de todas las edades, en una variedad de condiciones
que incluyen injuria cerebral traumática, hipóxica e
isquémica. La hipotermia actúa reduciendo la demanda
metabólica neuronal, la acumulación de citotoxinas y
previniendo la apoptosis
(6-7)
Las revisiones sistemáticas más recientes
(8-10)
no incluyen los ensayos multicéntricos de gran tamaño
muestral que se han publicado durante estos dos últimos años
(11-12),
lo que podría implicar alguna deficiencia en el estado
actual del conocimiento, es por ello, que el objetivo de
este meta análisis fue actualizar y revisar la efectividad y
seguridad de la hipotermia en el tratamiento de la
encefalopatía hipóxico isquémica.
MATERIAL Y MÉTODOS
Se planeó realizar un meta análisis de los ensayos clínicos
controlados y aleatorizados que compararan hipotermia
terapéutica moderada (cefálica exclusiva o corporal total)
con normotermia en recién nacidos a término con
encefalopatía hipóxico isquémica. Se consideró la presencia
de asfixia perinatal si se cumplían al menos uno de los
siguientes criterios: Puntaje Apgar menor de 5 a los 10
minutos de vida, un exceso de bases mayor o igual a 12 en la
primera hora de vida y/o maniobras de resucitación o
ventilación mecánica a los 10 minutos de vida. La aparición
de EHI se definió según el examen neurológico estandarizado
propuesto por Finer y colaboradores(13),
que es una modificación del propuesto originalmente por
Sarnat. Se excluyeron los recién nacidos con malformaciones
congénitas mayores.
Los resultados primarios fueron mortalidad y secuelas
neurológicas (SN) moderadas a severas, incluyendo parálisis
cerebral (PC) de acuerdo al Sistema de Clasificación de la
Función Motora Gruesa (GMF)(14)
y de las escalas de Griffiths(15)
o Bayley(16).
Déficit visual (< 6/60) en ambos ojos y pérdida auditiva que
hubiera requerido amplificación.
Los resultados secundarios incluyeron los eventos adversos
resultantes del tratamiento: arritmia (cualquiera de ellas),
hipotensión (presión arterial media menor de 40 mm Hg),
coagulapatía, función renal anormal ( diuresis < 0,5 ml/kg/día
o creatinina sérica > de 0,09 mmol/l), disfunción hepática
(aspartato aminotransferasa > 200 UI/l y alanina
aminotransferasa > 100 UI/l), sepsis sospechada o
documentada por cultivos y presencia de convulsiones.
Se realizó una búsqueda bibliográfica sistemática durante
octubre de 2009. Se investigó en las bases de datos Cochrane
Central Register of Controlled Trials, MEDLINE, LILACS y
Google Académico utilizando los siguientes términos: a)
Población: “Infant, Newborn” [MeSH] AND b) Intervención: (Hypothermia
[MeSH] OR “Hypothermia, Induced” [MeSH] AND c) Condición:
“Asphyxia” [MeSH] OR “Asphyxia Neonatorum” [MeSH] OR
“Hypoxia-Ischemia, Brain” [MeSH] OR “Hypoxic Ischenic
Encephalophaty” AND d) Comparación: “Clinical trials”,
“controlled clinical trials”, “randomized controlled trials”,
“random allocation”, “control group” [MeSH], AND “evaluation
studies” [MeSH].
También se revisaron las referencias pertinentes de los
artículos recuperados y se realizó una búsqueda manual en la
biblioteca de la Facultad de Medicina de la Universidad
Católica de Córdoba y del Hospital Privado.
EC realizó el protocolo de revisión, AR, JB y EC realizaron
la búsqueda independientemente y evaluaron la calidad de los
trabajos de acuerdo a los criterios de inclusión. Cuando
existieron inconsistencias, éstas fueron resueltas mediante
discusión y posterior acuerdo entre los 3 autores. La
calidad de los trabajos fue valorada de acuerdo a: tamaño
muestral (<100 ó >100), método de aleatorización (aletorización
central e independiente o quasi-aleatorización), asignación
de los pacientes a los grupos (encubierta o no) ,
enmascaramiento de la intervención (simple ciego o no),
tiempo de seguimiento de sobrevivientes (>18 meses ó < de 18
meses) y porcentaje de sobrevivientes perdidos en el
seguimiento (< 10% ó > 10%). El sesgo de publicación trató
de controlarse mediante las pruebas de Begg y Egger y por la
confección de un gráfico de embudo(17).
Los datos extraídos se meta analizaron con el programa
Epidat v 3.1 para Windows (La Coruña, España). El Riesgo
Relativo (RR) se calculo con IC95%. La Reducción o
Incremento del Riesgo Absoluto (IRA, RRA) y el Número
Necesario a Beneficiar o a Perjudicar (NNB, NNP) con sus
respectivos IC95% se calcularon con el programa Calculadora
R y C (Madrid, España), sólo para las variables
significativas. La heterogeneidad se estimó por la prueba
del coeficiente de variación entre estudios (Precisión
estandarizada > de 3). Se utilizó un modelo de efectos
aleatorios. Los diagramas (forest plot) se confeccionaron
con el programa Comprehensive Meta Analysis v. 2
(que carece de una versión castellana).
RESULTADOS
En la búsqueda se recuperaron 29 artículos, de los cuales
(8,11-12,18-23), fueron
potencialmente relevantes. En la revisión de éstos sólo
(3,11-12,23)
cumplieron con los criterios de inclusión y tuvieron una
precisión estandarizada > de 3, quedando los mismos para su
meta análisis definitivo.
En la
tabla 1
se detallan las características principales y los motivos de
exclusión de los estudios que no ingresaron en el meta
análisis.
|
 |
Tabla 1. Estudios excluidos del meta
análisis |
En los 3 estudios incluidos se reunió un total de 751
pacientes. Todas Los resultados meta analizados fueron
recuperados en los 3 estudios, salvo la disfunción renal y
hepática que se omite en el estudio de Azzopardi(12),
en la
tabla 2
se describe la contribución de pacientes de cada estudio
para cada uno de los resultados en análisis.
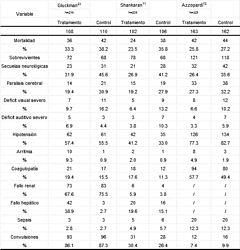 |
Tabla 2.
Número de pacientes en cada estudio.
Los porcentajes se calculan como eventos / total
para las variables secundarias (mortalidad y efectos
adversos). Las variables primarias (morbilidad
neurológica) se calculan como eventos/
sobrevivientes.
|
El análisis combinado de los totales no mostró una reducción
significativa de la mortalidad ni de la ceguera y la
sordera, comparando el grupo de tratamiento con hipotermia
vs. el grupo control con normotermia. Las secuelas
neurológicas moderadas a severas fueron reducidas
significativamente, lo mismo que la prevalencia de parálisis
cerebral. Los eventos adversos asociados estadísticamente al
tratamiento fueron: arritmias y trastornos de la
coagulación, mientras que no lo estuvieron la hipotensión,
la sepsis, las convulsiones, el fallo hepático y la
disfunción renal, como puede observarse en la
tabla 3.
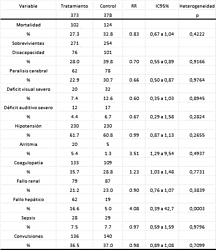 |
Tabla
3. Efectividad y seguridad de la hipotermia
terapéutica vs. control con normotermia (totales).
Los
porcentajes se calculan como eventos / total para
las variables secundarias (mortalidad y efectos
adversos). Las variables primarias (morbilidad
neurológica) se calculan como eventos/
sobrevivientes.
|
La descripción en términos de reducción o aumento del riesgo
absoluto y del número necesario a beneficiar o perjudicar,
con sus respectivos intervalos de confianza del 95% para las
variables estadísticamente significativas, se expone en la
tabla 4.
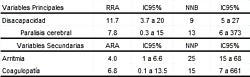 |
Tabla
4.
Riesgo Absoluto y Número Necesario de las variables
significativas.
RRA=
Reducción Riesgo Absoluto.
NNT=
Número Necesario a Beneficiar.
ARA=
Aumento del Riesgo Absoluto.
NNP= Número Necesario a Perjudicar.
|
En las
figuras 2 y 3
se muestran los diagramas (forest plot) para los resultados
primarios significativos, siendo estos las secuelas
neurológicas moderadas a severas y la parálisis cerebral, a
los 18 meses de seguimiento.
|
Figura 2. Secuelas neurológicas moderadas a
severas.
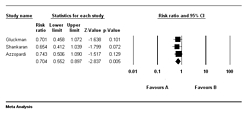 |
Figura 3. Parálisis cerebral en
sobrevivientes
 |
DISCUSIÓN
Los resultados de este meta análisis sugieren que la
hipotermia terapéutica reduce significativamente el riego de
secuelas neurológicas moderadas a severas y de parálisis
cerebral a los 18 meses de seguimiento en recién nacidos a
término, que presentan EHI. La relativa homogeneidad y alta
calidad de los estudios permiten realizar esta afirmación
sobre bases bastante seguras.
En las revisiones sistemáticas previas de mayor importancia(10-12),
se tomo como variable principal el combinado de mortalidad
más secuelas neurológicas moderadas a severas, lo que a
nuestro entender, sesga los resultados, debido básicamente a
que la fusión de dos variables en una sola, sobreestima el
efecto de una de ellas, implicando que diferencias muy
pequeñas, puedan ser vistas como mayores(24),
es por ello que decidimos separar estas variables, y de
hecho éste es el primer meta análisis que así lo hace, y la
diferencia en el resultado en cuanto a las disminución del
riesgo de mortalidad, salta a la vista, ya que todas las
revisiones anteriores reportan una disminución significativa
de la mortalidad, cuando claramente esto no es así.
En el resto de las variables primarias (morbilidad
neurológica: secuelas neurológicas, parálisis cerebral,
ceguera y sordera) y secundarias (eventos adversos:
arritmia, hipotensión, coagulopatía, sepsis, convulsiones,
fallo renal y hepático), todas fueron similares a las de
nuestro trabajo. Debe resaltarse que los resultados sobre
disfunción hepática deben tomarse con cautela, ya que los
mismos en los estudios meta analizados no son homogéneos, p
0,0003, ver
tabla 3.
La arritmia más frecuente es la bradicardia, que constituye
más una respuesta fisiológica a la hipotermia que un evento
adverso en sí. La trombocitopenia es la principal causa de
coagulopatía en los paciente enfriados, ya que tanto las
plaquetas como los leucocitos circulantes son secuestrados
por el hígado y el bazo durante la hipotermia; para luego,
durante el recalentamiento, retornar a la circulación; lo
que aparentemente no constituiría un problema clínico
relevante.
Los estudios examinados aún carecen de la potencia necesaria
para realizar un meta análisis por subgrupos de gravedad de
la EHI, este recurso posibilitaría sin duda, conocer con mas
propiedad cuáles serían los pacientes que obtendrían mayor
beneficio con la intervención. Lo mismo ocurre si se intenta
comparar si el enfriamiento cefálico difiere sustancialmente
del enfriamiento corporal total. Obviamente éstos tópicos
deberán investigarse concienzudamente en el futuro, y marcan
una limitación importante de la intervención.
Las fortalezas más destacadas de este meta análisis se basan
en la rigurosidad empleada para la inclusión de estudios de
alta calidad, homogéneos, de un peso estadístico similar,
metodológicamente muy similares y con tamaños muestrales
suficientes como para no sobreponer los intervalos de
confianza del 95% en el porcentaje de los eventos, tanto en
los grupos de tratamiento como de control.
Este meta analysis puede estar limitado por sesgos de
publicación, ya que los estudios con resultados negativos
suelen no ser publicados, este hecho trató de evitarse
mediante la búsqueda en las bases de datos de protocolos
inscriptos, como el Cochrane Central Register of Controlled
Trials, y la investigación manual en las bibliotecas a fin
de hallar literatura gris, que no aparece normalmente en los
índices de mayor importancia. Al no tener acceso a fuentes
de la envergadura de EMBASE y CINAHL, podemos no haber
identificado algún articulo relevante, incurriendo en un
sesgo de búsqueda sin intención o de falta de disponibilidad
de información.
La hipotermia terapéutica moderada, utilizada en forma
gradual y controlada para lograr la reducción de la
temperatura central en 2 ó 3 °C, iniciada 6 h después del
nacimiento y continuada por 72 h, seguida de un
recalentamiento lento, posee efectos neuroprotectores en los
recién nacidos a término con EHI, y permite reducir el riego
de secuelas neurológicas moderadas a severas y de parálisis
cerebral. Los estudios bien diseñados que esto demuestran,
han sido realizados todos en países desarrollados con un
alto nivel tecnológico y de recursos humanos homogéneamente
distribuidos. Aunque se han desarrollado pequeños ensayos en
Turquía(19),
China(22)
y Uganda(25),
no puede afirmarse por esto que el tratamiento pueda ser
efectuado sin riesgos en los países en desarrollo, donde
posiblemente exista la necesidad de probar el tratamiento
con diferentes poblaciones y bajo diferentes condiciones. En
los países en desarrollo la encefalopatía neonatal
asfíctica, constituye por sí misma la principal causa de
mortalidad neonatal evitable. Es claro que una intervención
con un NNB de 9 generaría un gran beneficio potencial para
disminuir las secuelas neurológicas y la parálisis cerebral
en la EHI.
La extrapolación de la investigación llevada a cabo en los
países de altos ingresos a nuestro medio, es en realidad un
desafío muy complejo y su aplicación generalizada podría
estar acotada por las siguientes razones: a) Poca seguridad
de la intervención, ya que está demostrado que existe una
relación lineal entre hipotermia y mortalidad en
instituciones con escasos recursos(26).
b) La hipotermia podría inducir disfunción neutrófila y
aumentar la prevalencia de sepsis, hecho que posiblemente
esté enmascarado por la administración precoz de
antibióticos(10).
c) La alta prevalencia de restricción del crecimiento
intrauterino, aspiración meconial y nacimiento de recién
nacidos pequeños para la edad gestacional (con diferente
respuesta termogénica y termolítica), conformaría un tipo de
población manifiestamente diferente a la referenciada en los
estudios meta analizados. d) Los recién nacidos con grados
de asfixia más severos posiblemente tengan menores chances
de responder a la hipotermia, siendo éstos mucho más
prevalentes en los países de medios y bajos ingresos. e) La
eficacia del tratamiento, depende de su rápida instauración
(< 6 h), esto se ve muy poco factible en sitios donde la
regionalización y la derivación no se realizan en tiempo y
forma por falta de medios o por la baja calidad de la
atención sanitaria. f) Los dispositivos de enfriamiento son
completamente inaccesibles por su costo, salvo en centros
con recursos económicos, técnicos, humanos y académicos. El
uso de botellas frías o cubos de hielo, produce
fluctuaciones importantes en la temperatura cerebral,
produciendo daño y lesión neuronal, por lo que deben estar
absolutamente proscriptos(27).
La utilización de colchones térmicos que mantienen una
temperatura fija entre 24 y 36 hs, son un medio mucho más
económico, pero aún faltaría probar su eficacia y seguridad,
al igual que el uso terapéutico de los diferentes
dispositivos radiantes servo controlados de fabricación
local, por lo que en los países en desarrollo la hipotermia
terapéutica, salvo excepciones muy puntuales, debería aún
ser considerada experimental.
CONCLUSIONES
La evidencia extraída de los ensayos clínicos controlados y
aleatorizados de alta calidad que hemos meta analizado,
demuestra que la hipotermia terapéutica reduce
significativamente el riesgo de presentar secuelas
neurológicas moderadas a severas y parálisis cerebral, a los
18 meses de seguimiento en los sobrevivientes, sin presentar
eventos adversos clínicamente relevantes. La hipotermia
sería entonces una posibilidad atractiva para lograr una
neuroprotección aceptable en los recién nacidos a término
que padecen encefalopatía hipóxico isquémica aunque en los
países en desarrollo aún debería ser considerado un método
experimental.
BIBLIOGRAFÍA
1. Low JE, Lindslay BJ, Derrick EJ. Threshold at metabolic
acidosis associated with newborn complications. Am J Obstet
Gynecol 1997;77:1339-94.
[Abstract]
2. Lawn JE, Cousens S, Zupan J. Lancet Neonatal Survival
Steering Team. Four million neonatal deaths : when? were?
why? Lancet 2005;365:891-900.
[Abstract]
3. WHO. Department of Measurement and Health Information.
Estimated total death (´000), by cause and WHO Member State.
Geneva 2002(a). [Disponible en:
http://www.who.int/healthinfo/statistics/bodgbddeathdalyestimates.xls ]
[Consulta: 30 de octubre de 2009].
4. Shankaran S, Woldt E, Koepke T, Bedard MP, Nandyal R.
Acute neonatal morbidity and long-term central nervous
system sequelae of perinatal asphyxia in term infants. Early
Hum Dev 1991;25:135-48.
[Abstract]
5. Cuestas E, Caceres A, Palacio S. Animal models of injury
and repair in developing brain .Medicina (B Aires).
2007;67(2):177-82.
[Full Text]
6. Thoresen M, Penrice J, Lorek A, Cady EB, Wylezinska M,
Kirkbride V, Cooper CE, Brown GC, Edwards AD, Wyatt JS, et
al. Mild hypothermia after severe transient hypoxia-ischemia
ameliorates delayed cerebral energy failure in the newborn
piglet. Pediatr Res. 1995;37:667-70.
7. Laptook AR, Corbett RJ, Sterett R, Burns DK, Tollefsbol
G, Garcia D. Modest hypothermia provides partial
neuroprotection for ischemic neonatal brain. Pediatr Res.
1994;35:436-42.
8. Shah PS, Ohlsson A, Perlman M. Hypothermia to treat
neonatal hypoxic ischemic encephalopathy: systematic review.
Arch Pediatr Adolesc Med.2007;161:951-8.
9. Schulzke SM, Rao S, Patole SK. A systematic review of
cooling for neuroprotection in neonates with hypoxic
ischemic encephalopathy - are we there yet? BMC Pediatr.
2007;7:30. [Disponible en:
http://www.biomedcentral.com/1471-2431/7/30 ]
[Consulta 30 de octubre 2009].
10. Jacobs S, Hunt R, Tarnow-Mordi W, Inder T, Davis P.
Cooling for newborns with hypoxic ischaemic encephalopathy.
Cooling for newborns with hypoxic ischaemic encephalopathy.
Cochrane Database Syst Rev. 2007,4:CD003311. [Disponible en:
www.cohrane.org ] [Consulta 30 de octubre 2009].
11. Shankaran S, Pappas A, Laptook AR, McDonald SA,
Ehrenkranz RA, Tyson JE, Walsh M, Goldberg RN, Higgins RD,
Das A; NICHD Neonatal Research Network. Outcomes of safety
and effectiveness in a multicenter randomized, controlled
trial of whole-body hypothermia for neonatal hypoxic-ischemic
encephalopathy. Pediatrics. 2008;122:e791-8.
[Full Text]
12. Azzopardi DV, Strohm B, Edwards AD, Dyet L, Halliday HL,
Juszczak E, Kapellou O, Levene M, Marlow N, Porter E,
Thoresen M, Whitelaw A, Brocklehurst P; TOBY Study Group.
Moderate hypothermia to treat perinatal asphyxial
encephalopathy. N Engl J Med. 2009;361:1349-58.
[Full Text]
13. Finer NN, Robertson CM, Richards RT, Pinnell LE, Peters
KL. Hypoxic-ischemic encephalopathy in term neonates:
perinatal factors and outcome. J Pediatr. 1981;98:112-7.
[Abstract]
14. Palisano R, Rosenbaum P, Walter S, Russell D, Wood E,
Galuppi B. Development and reliability of a system to
classify gross motor function in children with cerebral
palsy. Dev Med Child Neurol. 1997;39:214-23.
[Abstract]
15. Griffiths R. The abilities of young children: a
comprehensive system of mental measurement for the first
eight years of life. Higth Wicombe, UK: The Test Agency
1970. [Citado por Schulzke S en: BMC Pediatr. 2007;7:30].
16. Bayley N. Bayley scales of infant development-II. San
Antonio. Texas: Psychological Corporation. 1993. [Citado por
Schulzke S en: BMC Pediatr. 2007;7:30].
17. Walker E, Hernandez AV, Kattan MW. Meta-analysis: Its
strength and limitations. Cleve Clin J Med. 2008;75:431-9.[Full
Text]
18. Gunn AJ, Gluckman PD, Gunn TR. Selective head cooling in
newborn infants after perinatal asphyxia: a safety study.
Pediatrics. 1998;102:885-92.
[Abstract]
19. Akisu M, Huseyinov A, Yalaz M, Cetin H, Kultursay N.
Selective head cooling with hypothermia suppresses the
generation of platelet-activating factor in cerebrospinal
fluid of newborn infants with perinatal asphyxia.
Prostaglandins Leukot Essent Fatty Acids. 2003;69:45-50.
[Abstract]
20. Bhat MA. Re: Therapeutic hypothermia following perinatal
asphyxia. Arch Dis Child Fetal Neonatal Ed. 2006;91:F464-5.
[Abstract]
21. Eicher DJ, Wagner CL, Katikaneni LP, Hulsey TC, Bass WT,
Kaufman DA, Horgan MJ, Languani S, Bhatia JJ, Givelichian LM,
Sankaran K, Yager JY. Moderate hypothermia in neonatal
encephalopathy: efficacy outcomes. Pediatr Neurol.
2005;32:11-7.
[Abstract]
22. Lin ZL, Yu HM, Lin J, Chen SQ, Liang ZQ, Zhang ZY. Mild
hypothermia via selective head cooling as neuroprotective
therapy in term neonates with perinatal asphyxia: an
experience from a single neonatal intensive care unit. J
Perinatol. 2006;26:180-4.
[Full
text]
23. Gluckman PD, Wyatt JS, Azzopardi D, Ballard R, Edwards
AD, Ferriero DM, Polin RA, Robertson CM, Thoresen M,
Whitelaw A, Gunn AJ. Selective head cooling with mild
systemic hypothermia after neonatal encephalopathy:
multicentre randomised trial. Lancet. 2005;365:663-70.
[Full Text]
24. Spector TD, Thompson SG. The potential and limitations
of meta-analysis. J Epidemiol Community Health.
1991;45:89-92
[Full text]
25. Robertson NJ, Nakakeeto M, Hagmann C, Cowan FM, Acolet
D, Iwata O, Allen E, Elbourne D, Costello A, Jacobs I.
Therapeutic hypothermia for birth asphyxia in low-resource
settings: a pilot randomised controlled trial. Lancet.
2008;372:801-3.
[Full text]
26. Mathur NB, Krishnamurthy S, Mishra TK. Evaluation of WHO
classification of hypothermia in sick extramural neonates as
predictor of fatality. J Trop Pediatr. 2005;51:341-5.
[Full text]
27. Horn AR, Woods DL, Thompson C, Eis I, Kroon M. Selective
cerebral hypothermia for post-hypoxic neuroprotection in
neonates using a solid ice cap. S Afr Med J. 2006;96:976-81.
[Full text]

|