TRABAJO ORIGINAL
Predictores de
coqueluche al ingreso en lactantes hospitalizados con
infección respiratoria aguda baja
Pertussis predictors in hospitalized
infants with acute lower respiratory tract infection
Moreno Laura
*, Montanaro Patricia****, Bujedo Elizabeth*, Cámara
Jorge**, Abilar C*, Terzoni M*, Romano M*, Marqués Inés*,
Quiroga Daniel*, Orecchini Alejandra***, Jacome Javier***,
Ferrero Fernando****.
Revista Facultad de Ciencias Medicas 2013; 70(2):63-69
*Cátedra de
Clínica Pediátrica UNC. Hospital de Niños Santísima Trinidad
de Córdoba.
**Instituto de Virología JM Vanella FCM UNC
*** Sec. Microbiologia. Serv. Laboratorio. Hospital de Niños
Santísima Trinidad de Córdoba.
**** Hospital de Niños Pedro Elizalde. Buenos Aires
Correspondencia:
Laura Moreno. Ferroviarios 1250. Córdoba. E-mail:
lauramoreno@arnet.com.ar .
|
Financiamiento: autofinanciado por los autores
Conflictos de interés: no se declaran conflicto de intereses
|
Introducción
La tos ferina o Coqueluche es una infección bacteriana aguda
de las vías respiratorias causada por Bordetella pertussis
(BP), de distribución universal y alta contagiosidad1 . La
incidencia de casos reportados, tanto en Argentina como en
el mundo, se ha incrementado en las últimas décadas aún en
países con altas coberturas de vacunación2,3. Los lactantes
menores son más susceptibles y propensos a desarrollar
formas graves de la enfermedad con mayores tasas de
hospitalización y muerte4.
A partir del 2003, en nuestro país comenzaron a registrarse
tasas de incidencia que aumentaron exponencialmente desde
0,7/105 durante el 2002 a 1,76/105 en el 2003 (aumento en
71%)5. En la provincia de Córdoba, el incremento de casos
de BP se documentó a partir del 2005 con la notificación de
60 casos, 345 en el año 2006 y 510 en el 2007, con una
elevación de 48% en relación con el año anterior y de un
750% respecto al 20056. En los reportes del sistema
nacional de vigilancia de laboratorios (SIVILA) se
registraron 1071 muestras positivas durante 2011 y 1135 en
el 2012 en todo el país7.
Este fenómeno se debería, entre otras causas, a que las
vacunas actualmente en uso, celulares y acelulares, no
evitan la colonización de una fracción de la población
vacunada ni la enfermedad en algunos sujetos, que permanecen
susceptibles, debido a la pérdida paulatina de la inmunidad
tanto natural como adquirida frente a B. pertussis. Tan es
así, que en Holanda, se ha reportado que alrededor de casos
índices de enfermedad, 10% de sus contactos hogareños se
comportaron como infectados asintomáticos. Otros estudios
han replicado ésta observación, que en momentos epidémicos,
10-20% de los contactos de casos índices alojan en su
faringe B. pertussis de manera silente, lo que se debe
interpretar como una portación cuya duración y trascendencia
epidemiológica son todavía inciertas, dada la falta de
información al respecto8.
La presentación clínica es variada y puede estar
influenciada por numerosos factores como la edad,
inmunocompetencia o el estado de inmunidad adquirida9.
Aunque la forma clásica presenta tos en accesos (tos
quintosa con “estridor” o ruido inspiratorio), vómitos,
cianosis y, eventualmente, apnea10, muchas veces puede
manifestarse como una infección respiratoria aguda (IRA)
indistinguible de la ocasionada por infecciones virales11.
Entre estos últimos, el VRS es el de mayor prevalencia y el
más relacionado a cuadros de apnea en este grupo etario12
La sospecha e identificación de casos de infección por BP es
fundamental en la práctica por la necesidad de intervenir
tempranamente a nivel clínico y epidemiológico implementando
tanto medidas terapéuticas, como de control del foco
infeccioso. Para ello, ha sido sugerida una “definición de
caso sospechoso” (diseñada con fines epidemiológicos) que
incorpora todas las características clínicas mencionadas
independientemente de la duración de la tos (eliminando la
condición de 14 días de duración de la misma). Esta
definición garantiza una alta sensibilidad, aunque presenta
baja especificidad13. Así, en meses de invierno, con alta
prevalencia de infecciones por VSR, resulta muy difícil su
discriminación.
Cosnes-Lambe y col, (2008) compararon características
clínicas de menores de 4 meses hospitalizados con IRA/bronquiolitis;
entre los casos positivos para virus respiratorio sincicial
(VRS) hallaron 16% positivos para coqueluche (14/90). Los
síntomas clínicos fueron similares entre los pacientes con
VRS con y sin coinfección con BP señalando la importancia de
sospechar coqueluche en lactantes con tos y apnea14.
Por otra parte, Guinto-Ocampo y col15, compararon signos
clínicos y valores del hemograma en menores de 12 meses con
diagnóstico positivo y negativo, respectivamente, para BP.
Sus resultados mostraron que mayores niveles de leucocitos
totales, porcentaje de linfocitos y linfocitos absolutos en
sangre periférica se asociaron significativamente con test
positivos; siendo este último, el mejor predictor de
pertussis en la muestra analizada.
El diagnóstico de coqueluche en fases agudas de la
enfermedad, es posible mediante técnicas de biología
molecular (PCR) y/o cultivo en secreciones nasofaríngeas con
sensibilidad y especificidad variable según el tiempo de
evolución y especialmente por la edad del paciente. (60% en
lactantes y 10% en niños mayores)16-18; sin embargo, en el
momento de tomar decisiones frente a un paciente que ingresa
al hospital, sus resultados no están disponibles
inicialmente. Es allí donde la discriminación por elementos
de la clínica y/o de laboratorio adquiere mayor relevancia.
El objetivo de este trabajo fue comparar síntomas, signos y
estudios complementarios al ingreso en lactantes
hospitalizados con infección respiratoria aguda (IRA) por BP
y por VSR a fin de establecer marcadores que posibiliten su
predicción clínica temprana.
Material y Método
Diseño: estudio observacional, analítico, transversal, de
casos cruzados
Población, material y método. Se identificaron todos los
casos de IRA y sospecha de coqueluche incluidos en el
Programa de Vigilancia Epidemiológica de Infecciones
Respiratorias vigente en el Hospital de Niños de la
Santísima Trinidad de Córdoba, Argentina, durante el período
2007-2012. A todos se les realizó una toma de secreciones
nasofaríngeas (NF) para identificar virus respiratorios
(detección de antígenos virales por infmunofluorescencia).
Para los fines del presente trabajo se compararon solamente
los casos de Coqueluche con los de virus respiratorio
Sincicial (VRS). Se calculó un tamaño muestral mínimo para
una prevalencia esperada en el grupo de expuestos de 30% y
de 10% en no expuestos, con una confianza de 95% y un poder
de 80%, de 170 pacientes. El muestreo fue sucesivo. Fueron
incluidos los niños menores 6 meses de edad, previamente
sanos, con diagnóstico etiológico confirmado. Las muestras
de aspirados NF fueron obtenidas al ingreso. De ambos grupos
se registraron datos epidemiológicos (edad, sexo, fecha de
diagnóstico), clínicos (presencia de tos en accesos,
cianosis, vómitos posterior a la tos, apneas, rinitis y
sibilancias) y de laboratorio (hemograma completo con
fórmula leucocitaria del momento del ingreso). Fueron
excluidos los cuadros graves (requerimiento de UCI/UTI o
fallecidos), y los casos de etiología mixta (virus y BP).
Análisis Estadístico. Se evaluó la asociación entre los
predictores y la etiología (BP o VSR) por medio de análisis
bivariado, calculando OR con sus IC95%. La diferencia entre
medias se valoró con prueba T y entre proporciones mediante
chi cuadrado Se identificó el mejor punto de corte de
leucocitos/linfocitos para identificar BP por medio de curva
ROC con IC95%. En todos los casos se asumió un nivel de
significación p<0,05.
Aspectos Éticos. El protocolo fue aprobado por el Comité
Institucional de Ética Hospitalaria. Todos los datos fueron
manejados en forma convenientemente disociada de aquellos
que permitieran establecer la filiación de cada sujeto,
preservando la identidad de los mismos.
Resultados
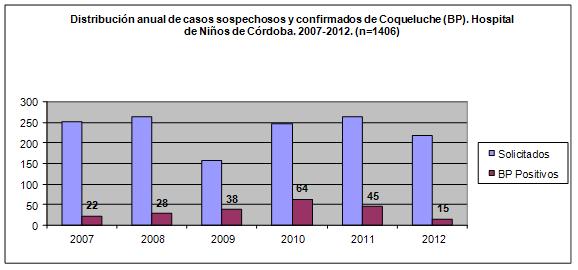
Durante el periodo estudiado (2007-2012) un total de 1406
menores de 6 meses fueron pesquizados para BP y virus
respiratorios en secreciones NF como parte del Programa de
Vigilancia Epidemiológico de IRA. Se detectaron 212 casos
positivos para BP (197 mediante técnicas de biología
molecular/PCR y 10 por cultivo) Ver Fig 1. Para el presente
análisis se excluyeron 38 casos (18%;IC95%:13-24); 25 por
coinfección BP/VSR (12%;IC95%:0,8-17) y 13 por requerir UTI
(6%; IC95%:0,3-10) (de ellos, 5 fallecidos/38%;IC%:15-67).
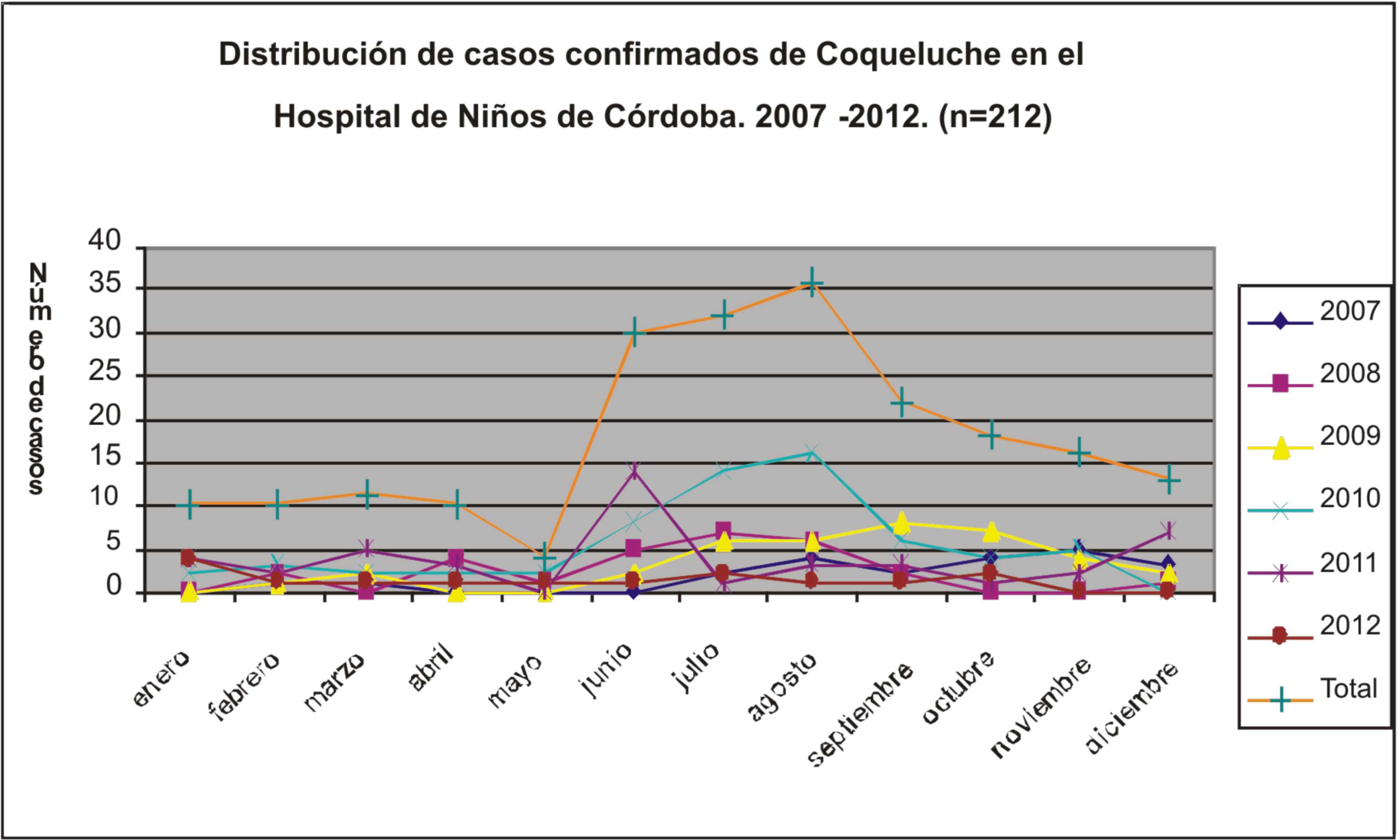
La fig 2 muestra la distribución estacional de los casos
confirmados de coqueluche durante el periodo estudiado. Se
observa un aumento de casos durante el periodo invernal
(junio-septiembre).
De los 187 casos positivos para VRS, 85 fueron excluidos
(45%;IC95%:38-52), según criterios: 25 coinfección con BP
(29%;IC95%:19-40), 45 por severidad (53%;IC95%:41-64), 15 co-morbilidades(18%;IC95%10-28).
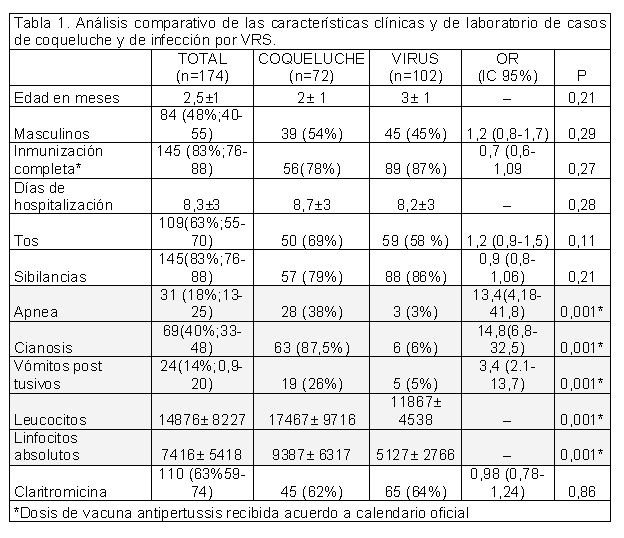
La muestra quedó constituida por 174 pacientes; 72 con BP
(41%;IC95%:33-48%) y 102 con VRS (59%;IC95%:51-66%). Sin
predominio de sexo: femeninos 90/174 (51%), edad media 2 ± 1
meses (rango 1-6). Las características clínicas y de
laboratorio de la muestra y las diferencias entre los casos
de coqueluche y de infecciones virales (VRS) se muestra en
la tabla 1. En ambos grupos se documentó sibilancias
(83%;IC95%:76-84), tos (63%;IC95%:55-70) y cianosis
(40%;IC95%:32-47), con menor prevalencia apnea
(18%;IC95%:12-24) y vómitos post tusivos (14%;IC95%:0,9-20).
El análisis bivariado mostró una fuerte asociación de los
síntomas incluidos en la definición de caso para coqueluche
con identificación de BP (apnea, cianosis, vómitos
posteriores al acceso de tos). Por lo contrario, no se
encontró diferencias con respecto a tos, ni sibilancias
(OR:1,2;IC95%:0,9-1,5;p:0,1 y OR:0,9;IC95%:0,8-1,06;p:0,2,
respectivamente)
La media de leucocitos totales en los casos de BP fue de
17467±9716/ml. El valor del recuento de linfocitos absolutos
(LA) fue significativamente mayor en los lactantes con BP
(9387± 6317 vs.5127± 2766; p<0,01). Una curva ROC identificó
>9000 cel/ml como el mejor punto del recuento de linfocitos
para diferenciar BP de VSR (área bajo la curva 0,73;
IC95%:0,64-0,81). La presencia de linfocitosis así definida
(> 9000 cel/ml se asoció significativamente con la
identificación de BP (OR:8,1; IC95%:2,9-22,7; p<0,01).
No se encontraron diferencias entra ambos grupos en lo que
respecta a días de hospitalización, tratamiento recibido, ni
prescripción de antibióticos.
|
 |
 |
 |
|
|
Figura 1.Distribución anual de
casos sospechosos y confirmados de Coqueluche.
Hospital de Niños Santísima Trinidad de
Córdoba.2007-2012 |
Figura 2. Distribución de casos
confirmados de Coqueluche en el Hospital de Niños
Santísima Trinidad de Córdoba (2007-2012) |
Tabla 1. Análisis comparativo de las
características clínicas y de laboratorio de casos
de coqueluche y de infección por VRS |
|
Discusión
En nuestro conocimiento, este es el primer trabajo original
que se publica sobre el tema en nuestro país.
Todos los síntomas incluidos en la definición de caso
sospechoso de coqueluche estuvieron presentes en ambos
grupos (BP y VRS) con distribución variable en cada uno. En
la totalidad de la muestra analizada, la tos en accesos fue
el signo más registrado seguido de crisis de cianosis y/o
cianosis posteriores a la tos, con menor frecuencia se
presentaron vómitos postusivos o ahogos con la tos y apnea.
La definición operativa propuesta por el CDC 13, y adoptada
por instituciones locales para sospechar coqueluche, intenta
instalar en la práctica pediátrica la alta sospecha clínica
en momentos de brote epidémico. Sin embargo, durante los
meses fríos con alta prevalencia de infecciones por VRS, la
pesquisa de casos así formulada puede generar un gran
porcentaje de “falsos positivos” (85% en nuestra muestra).
Heininger y col en 199719 describieron los signos y
síntomas presentes entre más de 2500 pacientes de todas las
edades con sospecha de coqueluche, tomando la tos de más de
7 días como criterio de inclusión. La positividad
diagnóstica con esa consigna fue del 12,4% (81,6% de falsos
positivos). Entre pacientes no vacunados, con BP confirmada
por cultivo, estos autores encontraron una prevalencia mayor
de tos paroxística inicial (82%) y vómitos postusivos (53%).
En nuestro trabajo, la variable tos no mostró asociación con
los casos confirmados de BP (69% vs 58 %); este hallazgo
podría explicarse por la corta edad de los pacientes (2,5
meses), susceptibles de presentar ahogos con la tos no
necesariamente prolongada, ni en accesos (característica
presentes en pacientes mayores)13. En los estudios de
Heininger19, con pacientes de 0 a 41 años de edad (media:
4,3 años), el 90% mostraron tos por más de 4 semanas durante
su evolución, alcanzando la definición de caso típica de tos
convulsa en 97% de los casos confirmados (definición que
incorporaba la duración de la tos a los signos
característicos). Por otra parte, la presencia de apneas en
los menores de 6 meses, fue del 15,9%, cifra muy inferior a
la identificada en nuestra población (38%), probablemente
relacionada con la distribución etaria de nuestros pacientes
(90% menores de 3 meses).
Las sibilancias estuvieron presentes en la mayoría de los
casos (83%) sin asociación con ninguno de los grupos (BP:
79% vs VRS: 86%). Si bien su presencia es característica de
las infecciones virales, es un hallazgo relativamente
frecuente en casos de coqueluche en el periodo de
lactante20. La edad de los pacientes, con predisposición
anatómica y funcional a la obstrucción de las vías aéreas
podría explicar este fenómeno21. Por otra parte, no podemos
descartar la presencia de coinfección con otros agentes no
investigados. Recientemente se ha descripto una elevada
proporción con cuadros respiratorios ocasionados por
rinovirus, agente que no es sistemáticamente pesquisado
prácticamente en ningún centro del mundo22.
En nuestra serie, el promedio de positividad en la
confirmación diagnóstica para BP fue del 15%; con cifras de
casos sospechosos anuales relativamente estables durante el
periodo estudiado. Estos datos son semejantes al referido en
documentos oficiales como SIVILA (Ministerio de Salud de la
Nación) que oscilan entre 13%-18%7,23.
El recuento de linfocitos absolutos en sangre periférica se
asoció significativamente a casos de BP en lactantes menores
de 6 meses con IRA y sospecha de coqueluche. El punto de
corte con mejor sensibilidad y especificidad de LA fue de
±9000/ml. Guinto-Ocampo y col15 propusieron un punto de
corte similar (± 9400/ml), aunque las series no son
exactamente comparables: los autores analizaron casos
positivos vs. negativos para BP, resultando el valor de
linfocitos como predictor de positividad para pertussis en
lactantes con bronquiolitis.
En relación al estado de inmunización, observamos que si
bien en la mayoría de los casos de coqueluche (78%) se
registró vacunación completa para la edad, por tratarse de
lactantes muy pequeños, ningún paciente tuvo oportunidad de
completar las dosis requeridas para asegurar un estado de
inmunización adecuado. Entre las hipótesis que intentan
explicar la reemergencia de la enfermedad se cuentan, entre
otras, la acumulación de portadores adolescentes y adultos
jóvenes por pérdida de la protección ofrecida por los
esquemas de vacunación (Tres dosis a los 2, 4 y 6 meses, con
dos refuerzos a los 18 meses y al ingreso escolar). En
función de los resultados de estudios epidemiológicos
reciente, en nuestro país se ha propuesto orientar las
medidas de control hacia la vacunación de mujeres
embarazadas desde la semana 20ª de gestación o en el
postparto inmediato junto a su pareja (estrategia de
“capullo”)24. Además, en el año 2008 se incorporaron al
esquema obligatorio de vacunación los refuerzos con la
triple adultos acelular a los adolescentes de entre 11 y 12
años25.
Con respecto al tratamiento, observamos que la prescripción
de antibióticos (claritromicina) en los casos de BP no
superó el 62%. Esto podría estar relacionado a las demoras
en la confirmación diagnóstica (entre 5-10 días para la
identificación de BP) que en un porcentaje de pacientes
excedió los días de hospitalización (8±2 días). Por otra
parte, sabemos que el tratamiento con antimicrobianos no ha
demostrado cambiar la evolución del cuadro clínico de
coqueluche, aunque evita la propagación de la enfermedad
entre los contactos y está recomendado para los casos graves
26. Por lo tanto, la sospecha e identificación de casos de
infección por BP, es fundamental en la práctica por la
necesidad de intervenir tempranamente a nivel clínico y
epidemiológico optimizando así las medidas terapéuticas y de
control del foco infeccioso27.
Entre los casos virales, por el contrario, más de la mitad
de los pacientes (64%) sí recibió tratamiento con
antimicrobianos (claritromicina con o sin ampicilina). Si
bien el tratamiento de las IRA ocasionadas por virus se basa
fundamentalmente en medidas de sostén, previniendo y
tratando la hipoxemia (o la insuficiencia respiratoria) que
resulta de la interacción agente-huésped, no es excepcional
su uso en cuadros de IRA. Se ha propuesto el uso de
macrólidos en el tratamiento de la bronquiolitis apelando a
sus propiedades inmunomoduladoras; sin embargo, las
evidencias no apoyan esa indicación28 por lo que no es una
pauta de rutina en nuestra institución. La sobreutilización
de antibióticos, por el contrario, promueve un aumento en la
resistencia de bacterias que colonizan las vías aéreas
superiores (como Streptococcus pneumoniae). Registros de la
Sección Microbiología del Hospital de donde provienen los
casos analizados, han evidenciado valores de resistencia de
neumococo a macrólidos que aumentaron desde 21,2% (2008) a
36%(2011)29.
Esta situación no hace más que confirmar las dificultades
existentes para decidir una medida terapéutica, a la vez que
documenta la necesidad de asumir una conducta más racional
en el uso de antimicrobianos para el tratamiento de este
tipo de pacientes.
La fortaleza más importante de este trabajo asienta en ser
el primero en nuestro país en analizar datos originales en
relación a las diferencias entre casos de BP y de VRS
aportando datos más precisos sobre la posibilidad de que
lactantes hospitalizados con diagnóstico de infección
respiratoria aguda baja puedan presentar, al ingreso, un
cuadro de coqueluche. Como debilidades debemos señalar la
posibilidad de haber incurrido en sesgos de selección e
información, especialmente en aquellos de memoria, aunque la
consistencia de nuestros datos con los de la bibliografía
hace pensar que esto podría no ser así. Por otra parte,
sabemos que la prueba diagnóstica más sensible y específica
de infección aguda es el estudio serológico para BP por lo
tanto, podría haber un subregistro de casos de coqueluche en
relación a la prevalencia encontrada. Sabemos que la
sensibilidad de la PCR es variable y depende de la situación
inmunitaria previa así como de la edad del paciente.
Concluimos que en menores de 6 meses hospitalizados por IRA,
algunos elementos clásicos de diagnóstico (apnea, cianosis y
linfocitosis) pueden ser útiles en diferenciar a los niños
con BP de aquellos con infecciones por VSR. Si bien la
sospecha clínica de casos para la identificación de BP son
medidas recomendadas para controlar la reemergencia de
coqueluche, los lactantes hospitalizados con IRA ofrecen la
oportunidad de un seguimiento particular que posibilite un
uso más racional de los antibióticos.
Referencias Bibliográficas
1.
Sangorrin A, Trenchs V, Curcoy A, García J. Tos ferina, una
entidad persistente. Enferm Infecc Microbiol Clin 2010;
28:206-7
Full text
2. Gentile A. Infección por Bordetella pertussis. Arch
Argent Pediatr 2010; 108:78-81
Full text
3. Gilberg S, Njamkepo E, Parent du Chaˆ telet I, Partouche
H, Gueirard P, Ghasarossian C, Schlumberger M, and Guiso N.
Evidence of Bordetella pertussis Infection in Adults
Presenting with Persistent Cough in a French Area with Very
High Whole-Cell Vaccine Coverage. The Journal of Infectious
Diseases 2002;186:415–8
PubMed -
Full text
4. Donoso A, León J, Ramírez M, Carrasco J. Coqueluche en
niños menores de seis meses de vida. Rev Chil Pediatr
2001;72-6
Scielo
5. Gentile A, Man C, Mistchenko A, Romanin V ,Salvay MC.
Brote de Bordetella pertussis en un hospital pediátrico. Rev
Hosp Niños Buenos Aires 2005; 47(214):211-6.
6. Sistema Nacional de Vigilancia Epidemiológica, Boletines
de Vigilancia Epidemiológica. Dirección Nacional de
Epidemiologia. Ministerio de Salud y Acción Social. Años
2003-2006.
7. Sistema Nacional de Vigilancia Epidemiológica, Boletines
de Vigilancia Epidemiológica. Dirección Nacional de
Epidemiologia. Ministerio de Salud y Acción Social. Año
2012.
8. de Greeff S C., Mooi F R, Westerhof A, Verbakel J M M,
Peeters M F, Heuvelman C J, et al. Pertussis disease burden
in the household: How to protect young infants. Clin Infect
Dis 2010; 50 (10): 1339-45
PubMed -
Full text
9. Long S. Tos ferina (Bordetella pertusis y parapertusis).
En: Behrman R, Kliegman R, Jenson B, Nelson A. Tratado de
Pediatria, editorial Elsevier España, 18ºed;2009:
pp1178-1182
10. Raymond J, Armengaud B, Gendrel D. Pertussis in young
infants: apnoea and intra-familial infection. Clin Microbiol
Infect. 2007; 13:172-5
PubMed
11. Donoso A y cols. Coqueluche grave. Estado del arte. Rev
Chil Infectol 2012; 29 (3): 290-306.
Scielo
12. Von Konog CH et al. A serologic study of organism
posibly associated with pertussislike coughing. Pediatr
Infect Dis J 1998;17:645-49.
PubMed -
Fulltext
13. Centers for Disease Control and prevention guide lines
for de controls of pertussis outbreak. Atlanta. 2009.
14. Cosnes-Lambe C, Raymond J, Chalumeau M, Pons-Catalano C,
Moulin F, Suremain N, Reglier-Poupet H, Lebon P, Poyart C,
Gendrel D. Pertussis and respiratory syncytial virus
infections, Eur J Pediatr 2008;167:1017–1019
PubMed
15. Guinto-Ocampo H, Bennett J, Attia M. Predicting
Pertussis in Infants. Pediatric Emerg 2008; 24:16-20.
PubMed
16. Wood N, McIntyre P. Pertussis: review of epidemiology,
diagnosis, managment and prevention. Pediatric Respiratory
Reviews 2008; 9:201-12
PubMed
17. Tozi A, Celentano L, Ciofi M, Salmaso S. Diagnosis and
managment of pertussis. CMAJ, 2005;172(4):509-15.
18. Van der Zee A. J infect Dis 1996;174:89-96.
PubMed -
Full text
19. Heininger U, Klich K, Stehr K and Cherry J. Clinical
Findings in Bordetella Pertussis Infections: Result of a
Prospective Multicenter Surveillance Study. Pediatrics
1997;100(6); e10.
PubMed
-
Full text
20. Piedimonte G. Pathophysiological mechanisms for the
respiratory syncytial virus-reactive airway disease link
Respiratory Research 2002, 3(Suppl 1):S21-S25.
PubMed Central
21. Mattoo S, Cherry JD. Molecular pathogenesis,
epidemiology, and clinical manifestations of respiratory
infections due to Bordetella pertussis and other Bordetella
subspecies. Clin Microbiol Rev. 2005 Apr;18(2):326-82.
Full text
22. Marcone DN, Ellis A, Videla C, Ekstrom J, Ricarte C,
Carballal G, Vidaurreta SM, Echavarría M. Viral Etiology of
Acute Respiratory Infections in Hospitalized and Outpatient
Children in Buenos Aires, Argentina. Pediatr Infect Dis J.
2013march; 3(32):105-110.
23. Boletín Integrado de Vigilancia N° 130. SE 30.
Secretaría de Promoción y programas sanitarios. Ministerio
de Salud de la Nación. Julio 2012.
24. Quian J, Cerisola A, RÜttimann R. Infecciones por
Bordetella pertussis en niños menores de un año
hospitalizados y sus contactos del hogar. Arch Pediatr Urug
2006; 77:229-36
Scielo
25. Ministerio de Salud Pública. Presidencia de la Nación.
Fundamentos de la vacunación en embarazadas con vacuna
Tripla Bacteriana Acelular (dTpa) Argentina 2012.
Full Text
26. Pinto L, Paulo M. Pitrez P, Luisi F, Piccoli de Mello P,
Gerhardt M, Ferlini R, Cardoso Barbosa D, Daros I, Jones M,
Stein R and Marostica P. Azithromycin Therapy in
Hospitalized Infants with Acute Bronchiolitis is Not
Associated with Better Clinical Outcomes: A
Randomized,Double-Blinded, and Placebo-Controlled Clinical
Trial. J Pediatr 2012:1-5
PubMed
27. Raymond J, Armengaud B, Gendrel D. Pertussis in young
infants: apnoea and intra-familial infection. Clin Microbiol
Infect. 2007; 13:172-5
PubMed
28. Centers for Disease Control and prevention guide lines
for de controls of pertussis outbreak. Atlanta. 2009.
29. Orecchini A. Resistencia a macrólidos de Streptococus
pneumoniae en Hospital de Niños Santísima Trinidad de
Córdoba. Libro de resúmenes de las Jornadas de Pediatría de
la Sociedad Argentina de Pediatría 2012.
|